21.3: מניעה וטיפול בזיהומים נגיפיים
- Page ID
- 206402
מיומנויות לפיתוח
- זיהוי מחלות ויראליות עיקריות המשפיעות על בני אדם
- השווה חיסונים ותרופות אנטי-ויראליות כגישות רפואיות לנגיפים
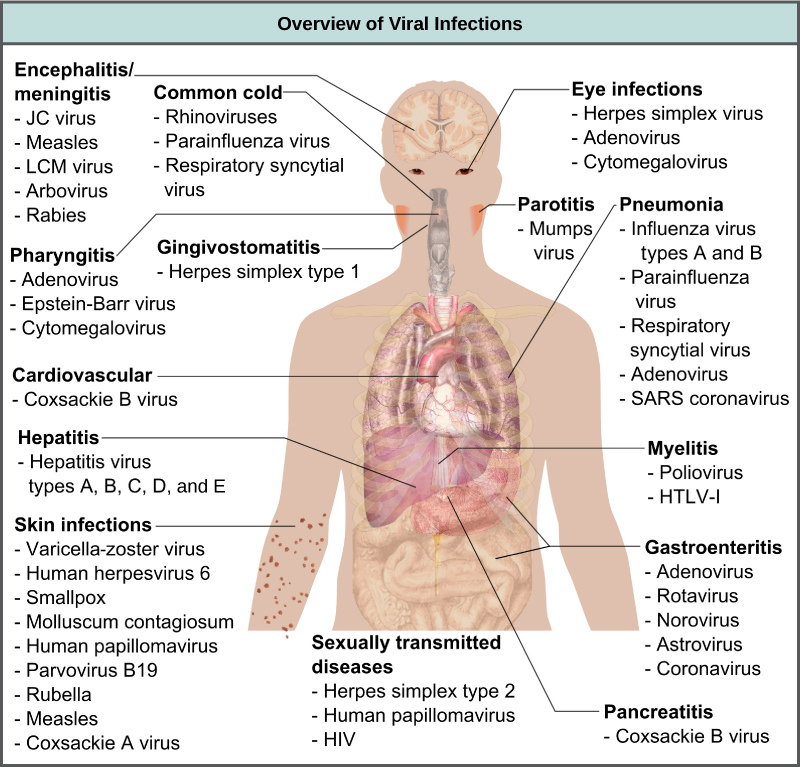
וירוסים גורמים למגוון מחלות בבעלי חיים, כולל בני אדם, החל מהצטננות ועד למחלות שעלולות להיות קטלניות כמו דלקת קרום המוח (איור\(\PageIndex{1}\)). ניתן לטפל במחלות אלו על ידי תרופות אנטי-ויראליות או על ידי חיסונים, אך נגיפים מסוימים, כמו HIV, מסוגלים גם להימנע מהתגובה החיסונית וגם להשתנות כדי להיות עמידים לתרופות אנטי-ויראליות.
חיסונים למניעה
אמנם יש לנו מספר מוגבל של תרופות אנטי-ויראליות יעילות, כגון אלו המשמשות לטיפול ב- HIV ושפעת, אך השיטה העיקרית לשליטה במחלות ויראליות היא על ידי חיסון, שנועד למנוע התפרצויות על ידי בניית חסינות למשפחת וירוסים או וירוסים (איור\(\PageIndex{1}\)). ניתן להכין חיסונים באמצעות וירוסים חיים, וירוסים מומתים או יחידות משנה מולקולריות של הנגיף. החיסונים הנגיפיים ההרוגים ונגיפי יחידת המשנה אינם מסוגלים לגרום למחלות.
חיסונים ויראליים חיים מתוכננים במעבדה כדי לגרום לתסמינים מעטים אצל הנמענים תוך מתן חסינות מגנה מפני זיהומים עתידיים. פוליו הייתה מחלה אחת שייצגה אבן דרך בשימוש בחיסונים. קמפיינים לחיסון המוני בשנות החמישים (חיסון נהרג) ו-1960 (חיסון חי) הפחיתו משמעותית את שכיחות המחלה, שגרמה לשיתוק שרירים אצל ילדים ויצרה פחד רב באוכלוסייה הכללית כאשר התרחשו מגיפות אזוריות. הצלחת חיסון הפוליו סללה את הדרך לחלוקה שגרתית של חיסוני ילדות נגד חצבת, חזרת, אדמת, אבעבועות רוח ומחלות אחרות.
הסכנה בשימוש בחיסונים חיים, שהם בדרך כלל יעילים יותר מחיסונים מומתים, היא הסכנה הנמוכה אך המשמעותית שנגיפים אלה יחזרו לצורתם הגורמת למחלות על ידי מוטציות גב. חיסונים חיים נעשים בדרך כלל על ידי החלשת (היחלשות) הנגיף "מסוג הבר" (הגורם למחלות) על ידי גידולו במעבדה ברקמות או בטמפרטורות שונות ממה שהנגיף רגיל למארח. הסתגלות לתאים או לטמפרטורות החדשות הללו גורמות למוטציות בגנום של הנגיף, ומאפשרות לו לצמוח טוב יותר במעבדה תוך עיכוב יכולתו לגרום למחלות כאשר הוא מוחדר מחדש לתנאים המצויים במארח. וירוסים מוחלשים אלה עדיין גורמים לזיהום, אך הם אינם גדלים היטב, ומאפשרים לתגובה החיסונית להתפתח בזמן כדי למנוע מחלות קשות. מוטציות גב מתרחשות כאשר החיסון עובר מוטציות במארח כך שהוא מסתגל מחדש למארח ויכול לגרום שוב למחלות, אשר לאחר מכן יכולות להתפשט לבני אדם אחרים במגיפה. תרחיש מסוג זה התרחש לאחרונה בשנת 2007 בניגריה, שם מוטציות בחיסון נגד פוליו הובילו למגיפה של פוליו במדינה זו.
חלק מהחיסונים נמצאים בפיתוח מתמשך מכיוון שלוירוסים מסוימים, כגון שפעת ו- HIV, יש שיעור מוטציות גבוה בהשוואה לנגיפים אחרים ותאי מארח רגילים. עם שפעת, מוטציות במולקולות פני השטח של הנגיף עוזרות לאורגניזם להתחמק מהחסינות המגנה שאולי הושגה בעונת שפעת קודמת, מה שמאפשר לאנשים להתחסן מדי שנה. נגיפים אחרים, כמו אלה הגורמים למחלות הילדות חצבת, חזרת ואדמת, משתנים לעתים רחוקות כל כך עד שמשתמשים באותו חיסון שנה אחר שנה.
קישור ללמידה
צפה בסרטון NOVA זה כדי ללמוד כיצד מיקרוביולוגים מנסים לשחזר את נגיף השפעת הספרדי הקטלני משנת 1918 כדי שיוכלו להבין יותר על וירולוגיה.
חיסונים ותרופות אנטי-ויראליות לטיפול
במקרים מסוימים ניתן להשתמש בחיסונים לטיפול בזיהום ויראלי פעיל. הרעיון שעומד מאחורי זה הוא שעל ידי מתן החיסון, החסינות מוגברת מבלי להוסיף עוד וירוס הגורם למחלות. במקרה של כלבת, מחלה נוירולוגית קטלנית המועברת דרך הרוק של בעלי חיים הנגועים בנגיף הכלבת, התקדמות המחלה מרגע עקיצת החיה ועד כניסתה למערכת העצבים המרכזית עשויה להיות שבועיים או יותר. זה מספיק זמן כדי לחסן אדם שחושד כי הם ננשכו על ידי חיה כלבת, והתגובה החיסונית המוגברת שלהם מספיקה כדי למנוע את הנגיף מלהיכנס לרקמת העצבים. לפיכך, ההשלכות הנוירולוגיות שעלולות להיות קטלניות של המחלה נמנעות, והאדם צריך רק להתאושש מהנשיכה הנגועה. גישה זו משמשת גם לטיפול באבולה, אחד הנגיפים המהירים והקטלניים ביותר על פני כדור הארץ. מחלה זו מועברת על ידי עטלפים וקופים גדולים, עלולה לגרום למוות בקרב 70-90 אחוז מבני האדם הנגועים תוך שבועיים. באמצעות חיסונים שפותחו לאחרונה המגבירים את התגובה החיסונית בדרך זו, יש תקווה כי אנשים מושפעים יוכלו לשלוט טוב יותר בנגיף, מה שעלול להציל אחוז גדול יותר של אנשים נגועים ממוות מהיר וכואב מאוד.
דרך נוספת לטיפול בזיהומים ויראליים היא השימוש בתרופות אנטי-ויראליות. לתרופות אלו לרוב יש הצלחה מוגבלת בריפוי מחלות נגיפיות, אך במקרים רבים הן שימשו לשליטה והפחתת תסמינים למגוון רחב של מחלות נגיפיות. עבור רוב הנגיפים, תרופות אלו יכולות לעכב את הנגיף על ידי חסימת הפעולות של אחד או יותר מחלבוניו. חשוב שהחלבונים הממוקדים יהיו מקודדים על ידי גנים ויראליים ושמולקולות אלו אינן קיימות בתא מארח בריא. בדרך זו, צמיחה ויראלית מעוכבת מבלי לפגוע במארח. ישנם מספר רב של תרופות אנטי-ויראליות הזמינות לטיפול בזיהומים, חלקן ספציפיות לנגיף מסוים ואחרות שיכולות להשפיע על וירוסים מרובים.
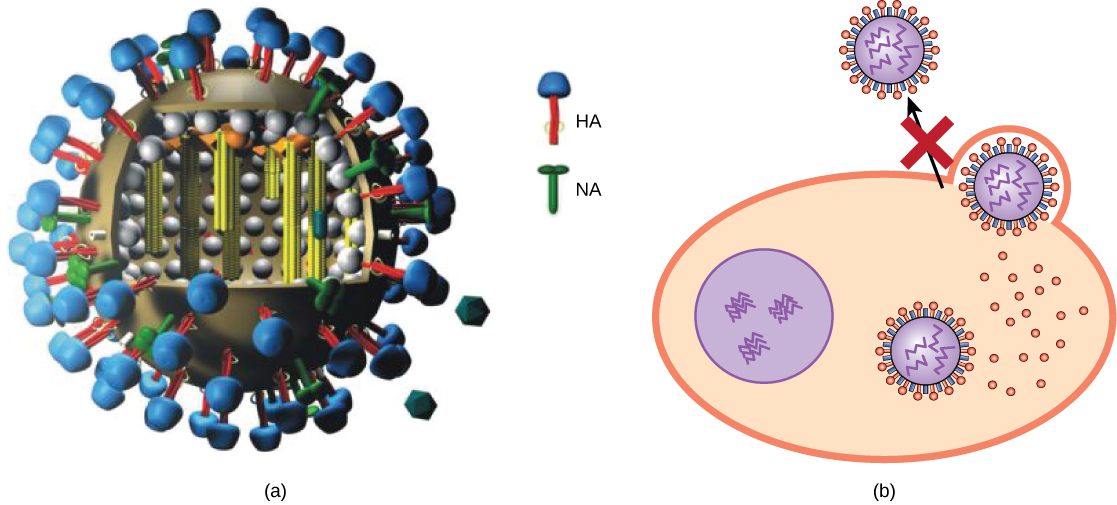
תרופות אנטי-ויראליות פותחו לטיפול בהרפס גניטלי (הרפס סימפלקס II) ושפעת. עבור הרפס גניטלי, תרופות כגון acyclovir יכול להפחית את מספר ומשך פרקים של מחלה ויראלית פעילה, שבמהלכם חולים לפתח נגעים ויראליים בתאי העור שלהם. מכיוון שהנגיף נשאר סמוי ברקמת העצבים בגוף לכל החיים, תרופה זו אינה מרפאת אך יכולה להפוך את תסמיני המחלה לניתנים לניהול יותר. עבור שפעת, תרופות כמו טמיפלו (oseltamivir) (איור\(\PageIndex{3}\)) יכולות להפחית את משך תסמיני "שפעת" ביום או יומיים, אך התרופה אינה מונעת תסמינים לחלוטין. טמיפלו פועל על ידי עיכוב אנזים (נוירמינידאז ויראלי) המאפשר לווירונים חדשים לעזוב את התאים הנגועים שלהם. לפיכך, טמיפלו מעכב את התפשטות הנגיף מתאים נגועים לתאים לא נגועים. תרופות אנטי-ויראליות אחרות, כגון Ribavirin, שימשו לטיפול במגוון זיהומים ויראליים, אם כי מנגנון הפעולה שלה נגד וירוסים מסוימים עדיין לא ברור.
ללא ספק, השימוש המוצלח ביותר בתרופות אנטי-ויראליות היה בטיפול ברטרו-וירוס HIV, הגורם למחלה שאם אינה מטופלת היא בדרך כלל קטלנית תוך 10-12 שנים לאחר ההדבקה. תרופות נגד HIV הצליחו לשלוט בשכפול הנגיפי עד כדי כך שאנשים המקבלים תרופות אלו שורדים זמן רב משמעותית מהלא מטופלים.
תרופות נגד HIV מעכבות שכפול ויראלי בשלבים רבים ושונים של מחזור השכפול של HIV (איור\(\PageIndex{4}\)). פותחו תרופות המעכבות את היתוך המעטפת הנגיפית של ה- HIV עם קרום הפלזמה של התא המארח (מעכבי היתוך), המרת גנום ה- RNA שלו ל- DNA דו-גדילי (מעכבי טרנסקריפטאז הפוך), שילוב ה- DNA הנגיפי בגנום המארח (מעכבי אינטגראז) ועיבוד חלבונים נגיפיים (מעכבי פרוטאז).
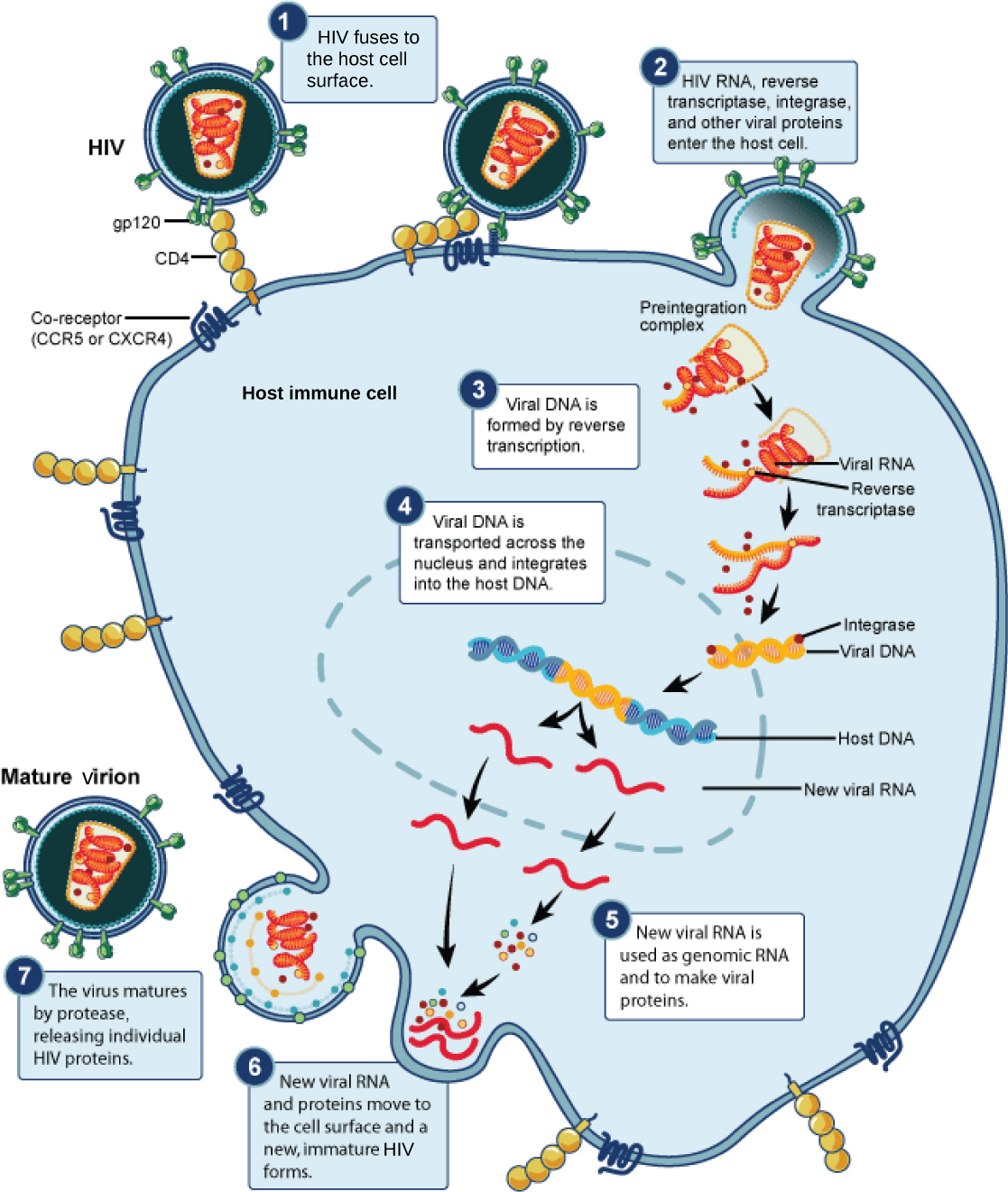
כאשר כל התרופות הללו משמשות בנפרד, שיעור המוטציות הגבוה של הנגיף מאפשר לו לפתח בקלות ובמהירות עמידות לתרופה, דבר המגביל את יעילות התרופה. פריצת הדרך בטיפול ב- HIV הייתה פיתוח HAART, טיפול אנטי-רטרו-ויראלי פעיל ביותר, הכולל תערובת של תרופות שונות, המכונות לעיתים "קוקטייל" תרופתי. על ידי תקיפת הנגיף בשלבים שונים של מחזור השכפול שלו, קשה הרבה יותר לנגיף לפתח עמידות למספר תרופות בו זמנית. ובכל זאת, אפילו בשימוש בטיפול משולב ב- HAART, קיים חשש שעם הזמן הנגיף יפתח עמידות לטיפול זה. לפיכך, תרופות חדשות נגד HIV מפותחות ללא הרף בתקווה להמשיך במאבק נגד הנגיף הקטלני ביותר הזה.
חיבור יומיומי: וירולוגיה יישומית
המחקר של וירוסים הוביל לפיתוח של מגוון דרכים חדשות לטיפול במחלות לא ויראליות. וירוסים שימשו בטיפול גנטי. טיפול גנטי משמש לטיפול במחלות גנטיות כמו ליקוי חיסוני משולב חמור (SCID), מחלה תורשתית ורצסיבית בה ילדים נולדים עם מערכת חיסון נפגעת קשה. סוג נפוץ אחד של SCID נובע ממחסור באנזים, אדנוסין דימינאז (ADA), המפרק בסיסי פורין. כדי לטפל במחלה זו על ידי טיפול גנטי, תאי מוח העצם נלקחים מחולה SCID ואת הגן ADA מוכנס. כאן נכנסים וירוסים, והשימוש בהם מסתמך על יכולתם לחדור לתאים חיים ולהביא איתם גנים. וירוסים כגון אדנווירוס, וירוס אנושי בדרכי הנשימה העליונות, משתנים על ידי הוספת הגן ADA, ואז הנגיף מעביר את הגן הזה לתא. התאים שהשתנו, המסוגלים כעת לייצר ADA, מוחזרים לאחר מכן לחולים בתקווה לרפא אותם. טיפול גנטי באמצעות וירוסים כנשא גנים (וקטורים ויראליים), אם כי עדיין ניסיוני, טומן בחובו הבטחה לטיפול במחלות גנטיות רבות. ובכל זאת, יש לפתור בעיות טכנולוגיות רבות כדי שגישה זו תהיה שיטה בת קיימא לטיפול במחלות גנטיות.
שימוש רפואי נוסף בנגיפים מסתמך על הספציפיות והיכולת שלהם להרוג את התאים שהם מדביקים. וירוסים אונקוליטיים מתוכננים במעבדה במיוחד כדי לתקוף ולהרוג תאים סרטניים. אדנו-וירוס מהונדס גנטית המכונה H101 שימש מאז 2005 בניסויים קליניים בסין לטיפול בסרטן ראש וצוואר. התוצאות היו מבטיחות, עם שיעור תגובה גבוה יותר לטווח הקצר לשילוב של כימותרפיה וטיפול ויראלי מאשר לטיפול כימותרפי בלבד. מחקר מתמשך זה עשוי לבשר על תחילתו של עידן חדש של טיפול בסרטן, שבו וירוסים מתוכננים למצוא תאים סרטניים ולהרוג אותם באופן ספציפי, ללא קשר למקום בו הם התפשטו בגוף.
שימוש שלישי בנגיפים ברפואה מסתמך על הספציפיות שלהם וכולל שימוש בבקטריופאגים בטיפול בזיהומים חיידקיים. מחלות חיידקיות טופלו באנטיביוטיקה מאז שנות הארבעים. עם זאת, לאורך זמן, חיידקים רבים פיתחו עמידות לאנטיביוטיקה. דוגמה טובה היא Staphylococcus aureus עמיד למתיצילין (MRSA, מבוטא "מרסה"), זיהום הנרכש בדרך כלל בבתי חולים. חיידק זה עמיד בפני מגוון רחב של אנטיביוטיקה, מה שמקשה על הטיפול. השימוש בבקטריופאגים ספציפיים לחיידקים כאלה יעקוף את עמידותם לאנטיביוטיקה ויהרוג אותם באופן ספציפי. למרות שטיפול בפאג' נמצא בשימוש ברפובליקה של ג'ורג'יה לטיפול בחיידקים עמידים לאנטיביוטיקה, השימוש בו לטיפול במחלות אנושיות לא אושר ברוב המדינות. עם זאת, בטיחות הטיפול אושרה בארצות הברית כאשר מינהל המזון והתרופות האמריקני אישר ריסוס בשרים בבקטריופאגים כדי להשמיד את פתוגן המזון ליסטריה. ככל שמתפתחים יותר ויותר זנים עמידים לאנטיביוטיקה של חיידקים, השימוש בבקטריופאגים עשוי להוות פתרון פוטנציאלי לבעיה, ופיתוח טיפול בפאג' מעניין מאוד חוקרים ברחבי העולם.
סיכום
וירוסים גורמים למגוון מחלות בבני אדם. ניתן למנוע רבות ממחלות אלה על ידי שימוש בחיסונים נגיפיים, המעוררים חסינות הגנה מפני הנגיף מבלי לגרום למחלות קשות. ניתן להשתמש בחיסונים נגיפיים גם בזיהומים ויראליים פעילים, מה שמגביר את יכולתה של מערכת החיסון לשלוט או להשמיד את הנגיף. סדרה של תרופות אנטי-ויראליות המכוונות לאנזימים ומוצרי חלבון אחרים של גנים ויראליים פותחו והשתמשו בהן בהצלחה מעורבת. שילובים של תרופות נגד HIV שימשו לשליטה יעילה בנגיף, והאריכו את תוחלת החיים של אנשים נגועים. לנגיפים שימושים רבים בתרופות, כמו למשל בטיפול בהפרעות גנטיות, סרטן וזיהומים חיידקיים.
רשימת מילים
- הנחתה
- היחלשות של וירוס במהלך פיתוח החיסון
- מוטציה אחורית
- כאשר חיסון וירוס חי חוזר אליו פנוטיפ הגורם למחלות
- ריפוי גנטי
- טיפול במחלות גנטיות על ידי הוספת גנים, שימוש בנגיפים לשאת את הגנים החדשים בתוך התא
- וירוס אונקוליטי
- וירוס מהונדס להדביק ולהרוג תאים סרטניים באופן ספציפי
- טיפול בפאג
- טיפול במחלות חיידקיות באמצעות בקטריופאגים ספציפיים לחיידק מסוים
- חיסון
- פתרון מוחלש של רכיבי וירוס, וירוסים או סוכנים אחרים המייצרים תגובה חיסונית


