10.3: שליטה במחזור התא
- Page ID
- 205754
מיומנויות לפיתוח
- להבין כיצד מחזור התא נשלט על ידי מנגנונים פנימיים וחיצוניים לתא
- הסבר כיצד שלושת מחסומי הבקרה הפנימית מתרחשים בסוף G 1, במעבר G 2/M ובמהלך המטאפאזה
- תאר את המולקולות השולטות במחזור התא באמצעות ויסות חיובי ושלילי
אורך מחזור התא משתנה מאוד, אפילו בתוך התאים של אורגניזם בודד. בבני אדם, תדירות תחלופת התאים נעה בין מספר שעות בהתפתחות העוברית המוקדמת, לממוצע של יומיים עד חמישה ימים לתאי אפיתל, ועד חיים שלמים של בני אדם שהושקעו ב-G 0 על ידי תאים מיוחדים, כגון נוירונים בקליפת המוח או תאי שריר לב. יש גם שונות בזמן שתא מבלה בכל שלב במחזור התא. כאשר תאי יונקים המתחלקים במהירות גדלים בתרבית (מחוץ לגוף בתנאי גידול אופטימליים), אורך המחזור הוא כ -24 שעות. בתאים אנושיים המתחלקים במהירות עם מחזור תאים של 24 שעות, שלב G 1 נמשך כתשע שעות, שלב S נמשך 10 שעות, שלב G 2 נמשך כארבע וחצי שעות, ושלב M נמשך כחצי שעה. בעוברים מוקדמים של זבובי פירות, מחזור התא מסתיים תוך כשמונה דקות. עיתוי האירועים במחזור התא נשלט על ידי מנגנונים שהם פנימיים וחיצוניים לתא.
ויסות מחזור התא על ידי אירועים חיצוניים
הן ההתחלה והן העיכוב של חלוקת התא מופעלות על ידי אירועים חיצוניים לתא כאשר הוא עומד להתחיל בתהליך השכפול. אירוע עשוי להיות פשוט כמו מוות של תא סמוך או גורף כמו שחרור הורמונים מקדמי גדילה, כגון הורמון גדילה אנושי (HGH). חוסר HGH יכול לעכב חלוקת תאים, וכתוצאה מכך גמדות, בעוד יותר מדי HGH יכול לגרום gigantism. צפיפות תאים יכולה גם לעכב את חלוקת התאים. גורם נוסף שיכול ליזום חלוקת תאים הוא גודל התא; ככל שתא גדל, הוא הופך להיות לא יעיל בגלל הירידה ביחס פני השטח לנפח שלו. הפתרון לבעיה זו הוא לחלק.
לא משנה מה מקור ההודעה, התא מקבל את האות, וסדרת אירועים בתוך התא מאפשרת לו להמשיך לשלב. בהתקדמות מנקודת התחלה זו, יש לעמוד בכל פרמטר הנדרש במהלך כל שלב מחזור התא או שהמחזור לא יכול להתקדם.
רגולציה במחסומים פנימיים
חיוני שתאי הבת המיוצרים יהיו כפילויות מדויקות של תא האב. טעויות בשכפול או בהפצה של הכרומוזומים מובילות למוטציות שעשויות לעבור קדימה לכל תא חדש המופק מתא לא תקין. כדי למנוע מתא שנפגע להמשיך להתחלק, ישנם מנגנוני בקרה פנימיים הפועלים בשלושה מחסומי מחזור תאים עיקריים. מחסום הוא אחת מכמה נקודות במחזור התא האוקריוטי שבו ניתן לעצור את התקדמות התא לשלב הבא במחזור עד שהתנאים נוחים. מחסומים אלה מתרחשים בסמוך לסוף G 1, במעבר G 2/M ובמהלך המטאפאזה (איור). \(\PageIndex{1}\)
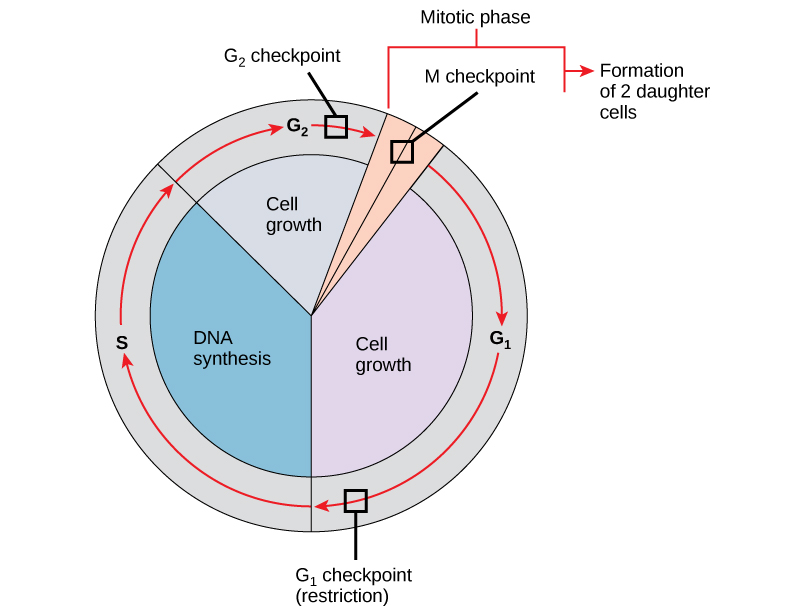
מחסום G 1
מחסום G 1 קובע אם כל התנאים נוחים להמשך חלוקת התא. מחסום G 1, הנקרא גם נקודת ההגבלה (בשמרים), הוא נקודה שבה התא מתחייב באופן בלתי הפיך לתהליך חלוקת התא. השפעות חיצוניות, כגון גורמי גדילה, ממלאות תפקיד גדול בהובלת התא מעבר למחסום G 1. בנוסף למאגרים נאותים ולגודל התא, יש בדיקה של נזק ל-DNA גנומי במחסום G 1. תא שאינו עומד בכל הדרישות לא יורשה להתקדם לשלב S. התא יכול לעצור את המחזור ולנסות לתקן את המצב הבעייתי, או שהתא יכול להתקדם ל-G 0 ולהמתין לאותות נוספים כאשר התנאים משתפרים.
מחסום G 2
מחסום G 2 חוסם כניסה לשלב המיטוטי אם לא מתקיימים תנאים מסוימים. כמו במחסום G 1, גודל התא ומאגרי החלבון מוערכים. עם זאת, התפקיד החשוב ביותר של מחסום G 2 הוא להבטיח שכל הכרומוזומים שוכפלו ושה-DNA המשוכפל לא ייפגע. אם מנגנוני המחסום מזהים בעיות ב- DNA, מחזור התא נעצר, והתא מנסה להשלים את שכפול ה- DNA או לתקן את ה- DNA הפגוע.
מחסום M
מחסום M מתרחש בסמוך לסוף שלב המטאפאזה של הקריוקינזיס. מחסום M ידוע גם בשם מחסום הציר, מכיוון שהוא קובע אם כל הכרומטידות האחיות מחוברות כראוי למיקרו-צינורות הציר. מכיוון שההפרדה של הכרומטידות האחיות במהלך אנאפאזה היא שלב בלתי הפיך, המחזור לא ימשיך עד שהקינטוכורים של כל זוג כרומטידות אחיות מעוגנים היטב לפחות לשני סיבי ציר הנובעים מקטבים מנוגדים של התא.
קישור ללמידה

צפה במה שקורה במחסומי G 1, G 2 ו- M על ידי ביקור באתר זה כדי לראות אנימציה של מחזור התא.
מולקולות הרגולטור של מחזור התא
בנוסף למחסומים הנשלטים באופן פנימי, ישנן שתי קבוצות של מולקולות תוך תאיות המווסתות את מחזור התא. מולקולות רגולטוריות אלו מקדמות את התקדמות התא לשלב הבא (ויסות חיובי) או עוצרות את המחזור (ויסות שלילי). מולקולות הרגולטור עשויות לפעול בנפרד, או שהן יכולות להשפיע על הפעילות או הייצור של חלבונים רגולטוריים אחרים. לכן, לכשל של רגולטור בודד אין כמעט השפעה על מחזור התא, במיוחד אם יותר ממנגנון אחד שולט באותו אירוע. לעומת זאת, ההשפעה של רגולטור לקוי או שאינו מתפקד יכולה להיות רחבת טווח ואולי קטלנית לתא אם תהליכים מרובים מושפעים.
ויסות חיובי של מחזור התא
שתי קבוצות של חלבונים, הנקראות ציקלינים וקינאזות תלויות ציקלין (Cdks), אחראיות להתקדמות התא דרך המחסומים השונים. הרמות של ארבעת חלבוני הציקלין משתנות לאורך מחזור התא בתבנית צפויה (איור \(\PageIndex{2}\)). Increases in the concentration of cyclin proteins are triggered by both external and internal signals. After the cell moves to the next stage of the cell cycle, the cyclins that were active in the previous stage are degraded.
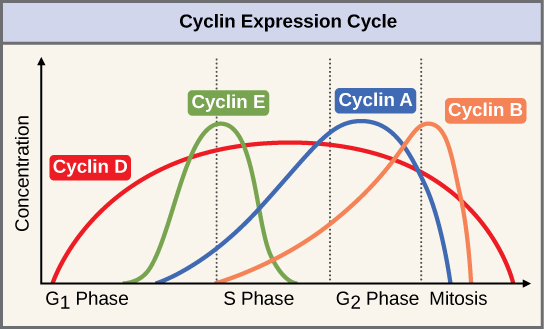
Cyclins regulate the cell cycle only when they are tightly bound to Cdks. To be fully active, the Cdk/cyclin complex must also be phosphorylated in specific locations. Like all kinases, Cdks are enzymes (kinases) that phosphorylate other proteins. Phosphorylation activates the protein by changing its shape. The proteins phosphorylated by Cdks are involved in advancing the cell to the next phase. (Figure \(\PageIndex{3}\)). The levels of Cdk proteins are relatively stable throughout the cell cycle; however, the concentrations of cyclin fluctuate and determine when Cdk/cyclin complexes form. The different cyclins and Cdks bind at specific points in the cell cycle and thus regulate different checkpoints.
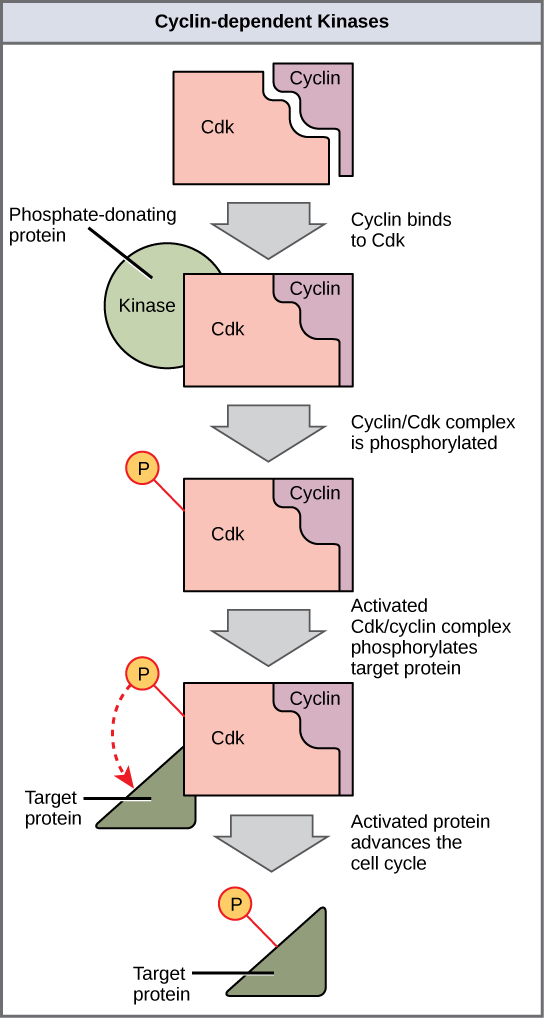
Since the cyclic fluctuations of cyclin levels are based on the timing of the cell cycle and not on specific events, regulation of the cell cycle usually occurs by either the Cdk molecules alone or the Cdk/cyclin complexes. Without a specific concentration of fully activated cyclin/Cdk complexes, the cell cycle cannot proceed through the checkpoints.
Although the cyclins are the main regulatory molecules that determine the forward momentum of the cell cycle, there are several other mechanisms that fine-tune the progress of the cycle with negative, rather than positive, effects. These mechanisms essentially block the progression of the cell cycle until problematic conditions are resolved. Molecules that prevent the full activation of Cdks are called Cdk inhibitors. Many of these inhibitor molecules directly or indirectly monitor a particular cell cycle event. The block placed on Cdks by inhibitor molecules will not be removed until the specific event that the inhibitor monitors is completed.
Negative Regulation of the Cell Cycle
The second group of cell cycle regulatory molecules are negative regulators. Negative regulators halt the cell cycle. Remember that in positive regulation, active molecules cause the cycle to progress.
The best understood negative regulatory molecules are retinoblastoma protein (Rb), p53, and p21. Retinoblastoma proteins are a group of tumor-suppressor proteins common in many cells. The 53 and 21 designations refer to the functional molecular masses of the proteins (p) in kilodaltons. Much of what is known about cell cycle regulation comes from research conducted with cells that have lost regulatory control. All three of these regulatory proteins were discovered to be damaged or non-functional in cells that had begun to replicate uncontrollably (became cancerous). In each case, the main cause of the unchecked progress through the cell cycle was a faulty copy of the regulatory protein.
Rb, p53, and p21 act primarily at the G1 checkpoint. p53 is a multi-functional protein that has a major impact on the commitment of a cell to division because it acts when there is damaged DNA in cells that are undergoing the preparatory processes during G1. If damaged DNA is detected, p53 halts the cell cycle and recruits enzymes to repair the DNA. If the DNA cannot be repaired, p53 can trigger apoptosis, or cell suicide, to prevent the duplication of damaged chromosomes. As p53 levels rise, the production of p21 is triggered. p21 enforces the halt in the cycle dictated by p53 by binding to and inhibiting the activity of the Cdk/cyclin complexes. As a cell is exposed to more stress, higher levels of p53 and p21 accumulate, making it less likely that the cell will move into the S phase.
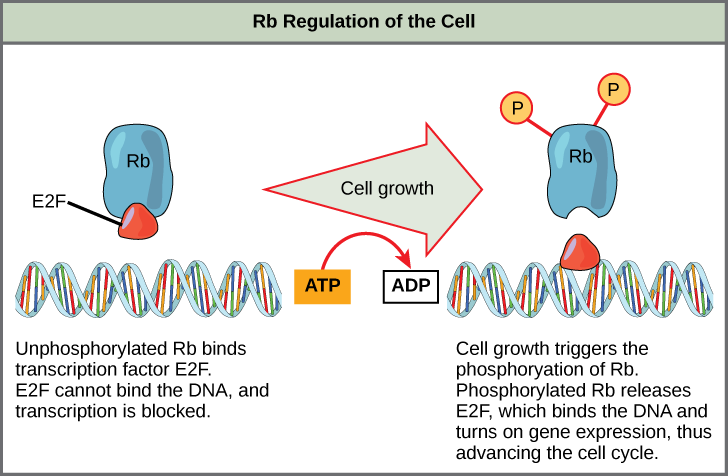
Rb exerts its regulatory influence on other positive regulator proteins. Chiefly, Rb monitors cell size. In the active, dephosphorylated state, Rb binds to proteins called transcription factors, most commonly, E2F (Figure \(\PageIndex{4}\)). Transcription factors “turn on” specific genes, allowing the production of proteins encoded by that gene. When Rb is bound to E2F, production of proteins necessary for the G1/S transition is blocked. As the cell increases in size, Rb is slowly phosphorylated until it becomes inactivated. Rb releases E2F, which can now turn on the gene that produces the transition protein, and this particular block is removed. For the cell to move past each of the checkpoints, all positive regulators must be “turned on,” and all negative regulators must be “turned off.”
Exercise \(\PageIndex{1}\)
Rb and other proteins that negatively regulate the cell cycle are sometimes called tumor suppressors. Why do you think the name tumor suppressor might be appropriate for these proteins?
- Answer
-
Rb and other negative regulatory proteins control cell division and therefore prevent the formation of tumors. Mutations that prevent these proteins from carrying out their function can result in cancer.
Summary
Each step of the cell cycle is monitored by internal controls called checkpoints. There are three major checkpoints in the cell cycle: one near the end of G1, a second at the G2/M transition, and the third during metaphase. Positive regulator molecules allow the cell cycle to advance to the next stage. Negative regulator molecules monitor cellular conditions and can halt the cycle until specific requirements are met.
Glossary
- cell cycle checkpoint
- mechanism that monitors the preparedness of a eukaryotic cell to advance through the various cell cycle stages
- cyclin
- one of a group of proteins that act in conjunction with cyclin-dependent kinases to help regulate the cell cycle by phosphorylating key proteins; the concentrations of cyclins fluctuate throughout the cell cycle
- cyclin-dependent kinase
- one of a group of protein kinases that helps to regulate the cell cycle when bound to cyclin; it functions to phosphorylate other proteins that are either activated or inactivated by phosphorylation
- p21
- cell cycle regulatory protein that inhibits the cell cycle; its levels are controlled by p53
- p53
- cell cycle regulatory protein that regulates cell growth and monitors DNA damage; it halts the progression of the cell cycle in cases of DNA damage and may induce apoptosis
- retinoblastoma protein (Rb)
- regulatory molecule that exhibits negative effects on the cell cycle by interacting with a transcription factor (E2F)


