3.4: חלבונים
- Page ID
- 206040
מיומנויות לפיתוח
- תאר את הפונקציות שחלבונים מבצעים בתא וברקמות
- דון בקשר בין חומצות אמינו לחלבונים
- הסבר את ארבע הרמות של ארגון החלבון
- תאר את הדרכים שבהן צורת החלבון ותפקודו מקושרים
חלבונים הם אחת המולקולות האורגניות הנפוצות ביותר במערכות חיות ויש להם את מגוון הפונקציות המגוון ביותר של כל המקרומולקולות. חלבונים עשויים להיות מבניים, רגולטוריים, מתכווצים או מגנים; הם עשויים לשמש בהובלה, אחסון או ממברנות; או שהם עשויים להיות רעלים או אנזימים. כל תא במערכת חיה עשוי להכיל אלפי חלבונים, שלכל אחד מהם תפקיד ייחודי. המבנים שלהם, כמו הפונקציות שלהם, משתנים מאוד. עם זאת, כולם פולימרים של חומצות אמינו, המסודרים ברצף ליניארי.
סוגים ותפקודים של חלבונים
אנזימים, המיוצרים על ידי תאים חיים, הם זרזים בתגובות ביוכימיות (כמו עיכול) והם בדרך כלל חלבונים מורכבים או מצומדים. כל אנזים הוא ספציפי למצע (מגיב הנקשר לאנזים) עליו הוא פועל. האנזים עשוי לסייע בתגובות פירוק, סידור מחדש או סינתזה. אנזימים המפרקים את המצעים שלהם נקראים אנזימים קטבוליים, אנזימים הבונים מולקולות מורכבות יותר מהמצעים שלהם נקראים אנזימים אנבוליים, ואנזימים המשפיעים על קצב התגובה נקראים אנזימים קטליטיים. יש לציין כי כל האנזימים מגבירים את קצב התגובה ולכן נחשבים לזרזים אורגניים. דוגמה לאנזים הוא עמילאז רוק, אשר מבצע הידרוליזה של המצע שלו עמילוז, מרכיב של עמילן.
הורמונים הם מולקולות איתות כימיות, בדרך כלל חלבונים קטנים או סטרואידים, המופרשים על ידי תאים אנדוקריניים הפועלים לשליטה או ויסות תהליכים פיזיולוגיים ספציפיים, כולל צמיחה, התפתחות, חילוף חומרים ורבייה. לדוגמה, אינסולין הוא הורמון חלבון המסייע לווסת את רמת הגלוקוז בדם. הסוגים והתפקודים העיקריים של חלבונים מפורטים בטבלה\(\PageIndex{1}\).
| הקלד | דוגמאות | פונקציות |
|---|---|---|
| אנזימי עיכול | עמילאז, ליפאז, פפסין, טריפסין | עזרה בעיכול המזון על ידי פירוק חומרים מזינים ליחידות מונומריות |
| תחבורה | המוגלובין, אלבומין | לשאת חומרים בדם או לימפה בכל הגוף |
| מבני | אקטין, טובולין, קרטין | בנה מבנים שונים, כמו שלד הציטוס |
| הורמונים | אינסולין, תירוקסין | לתאם את הפעילות של מערכות גוף שונות |
| הגנה | אימונוגלובולינים | הגן על הגוף מפני פתוגנים זרים |
| מתכווץ | אקטין, מיוסין | אפקט התכווצות שרירים |
| אחסון | חלבוני אחסון קטניות, חלבון ביצה (אלבומין) | לספק הזנה בהתפתחות מוקדמת של העובר והשתיל |
לחלבונים צורות ומשקלים מולקולריים שונים; חלק מהחלבונים הם בעלי צורה כדורית ואילו אחרים הם סיביים באופיים. לדוגמה, המוגלובין הוא חלבון כדורי, אבל קולגן, שנמצא בעור שלנו, הוא חלבון סיבי. צורת החלבון היא קריטית לתפקודו, וצורה זו נשמרת על ידי סוגים רבים ושונים של קשרים כימיים. שינויים בטמפרטורה, pH וחשיפה לכימיקלים עלולים להוביל לשינויים קבועים בצורת החלבון, מה שיוביל לאובדן תפקוד, המכונה דנטורציה. כל החלבונים מורכבים מסידורים שונים של אותם 20 סוגים של חומצות אמינו.
חומצות אמינו
חומצות אמינו הן המונומרים המרכיבים חלבונים. לכל חומצת אמינו אותו מבנה בסיסי, המורכב מאטום פחמן מרכזי, המכונה גם פחמן אלפא (α), הקשור לקבוצת אמינו (NH 2), קבוצת קרבוקסיל (COOH), ולאטום מימן. לכל חומצת אמינו יש גם אטום או קבוצת אטומים אחרים הקשורים לאטום המרכזי המכונה קבוצת R (איור\(\PageIndex{1}\)).
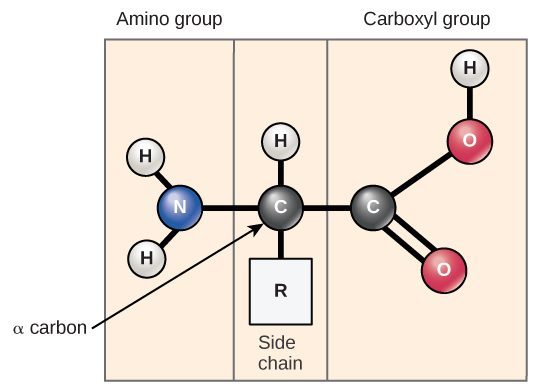
השם "חומצת אמינו" נגזר מהעובדה שהם מכילים גם קבוצת אמינו וגם קבוצת חומצות קרבוקסיל במבנה הבסיסי שלהם. כאמור, ישנם 20 חומצות אמינו בחלבונים. עשר מהן נחשבות לחומצות אמינו חיוניות בבני אדם מכיוון שגוף האדם אינו יכול לייצר אותן והן מתקבלות מהתזונה. עבור כל חומצת אמינו, קבוצת R (או שרשרת צד) שונה (איור\(\PageIndex{2}\)).
חיבור אמנות
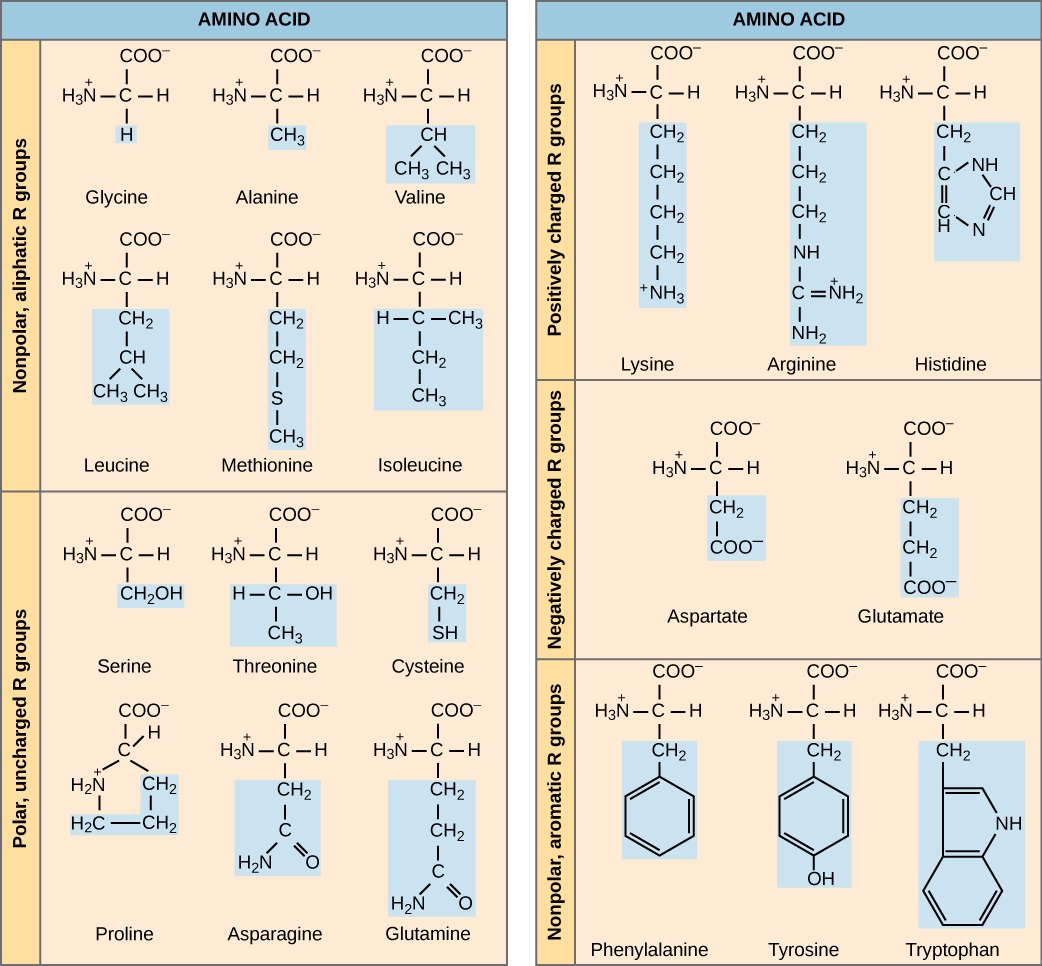
אילו קטגוריות של חומצת אמינו היית מצפה למצוא על פני השטח של חלבון מסיס, ואילו היית מצפה למצוא בפנים? איזו התפלגות של חומצות אמינו היית מצפה למצוא בחלבון המוטמע בשכבה דו-שומנית?
האופי הכימי של השרשרת הצדדית קובע את אופי חומצת האמינו (כלומר, בין אם היא חומצית, בסיסית, קוטבית או לא קוטבית). לדוגמה, לחומצת האמינו גליצין יש אטום מימן כקבוצת R. חומצות אמינו כגון ולין, מתיונין ואלנין אינן קוטביות או הידרופוביות באופיין, בעוד שחומצות אמינו כגון סרין, תראונין וציסטאין הן קוטביות ובעלות שרשראות צד הידרופיליות. שרשראות הצד של ליסין וארגינין טעונות באופן חיובי, ולכן חומצות אמינו אלו ידועות גם כחומצות אמינו בסיסיות. לפרולין יש קבוצת R המקושרת לקבוצת האמינו ויוצרת מבנה דמוי טבעת. פרולין הוא יוצא מן הכלל למבנה הסטנדרטי של חומצת אנימו מכיוון שקבוצת האמינו שלה אינה נפרדת מהשרשרת הצדדית (איור\(\PageIndex{2}\)).
חומצות אמינו מיוצגות על ידי אות אחת גדולה או קיצור בן שלוש אותיות. לדוגמה, valine ידוע על ידי האות V או סמל שלוש אותיות val. כשם שחלק מחומצות השומן חיוניות לתזונה, יש צורך גם בחומצות אמינו מסוימות. הם ידועים כחומצות אמינו חיוניות, ובבני אדם הם כוללים איזולאוצין, לאוצין וציסטאין. חומצות אמינו חיוניות מתייחסות לאלו הנחוצות לבניית חלבונים בגוף, אם כי אינן מיוצרות על ידי הגוף; אילו חומצות אמינו חיוניות משתנות מאורגניזם לאורגניזם.
הרצף ומספר חומצות האמינו קובעים בסופו של דבר את צורת החלבון, גודלו ותפקודו. כל חומצת אמינו מחוברת לחומצת אמינו אחרת על ידי קשר קוולנטי, המכונה קשר פפטיד, הנוצר על ידי תגובת התייבשות. קבוצת הקרבוקסיל של חומצת אמינו אחת וקבוצת האמינו של חומצת האמינו הנכנסת משתלבות ומשחררות מולקולת מים. הקשר שנוצר הוא הקשר הפפטיד (איור\(\PageIndex{3}\)).
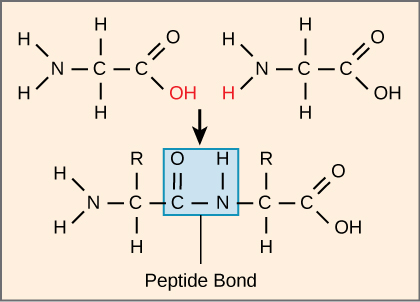
המוצרים שנוצרו על ידי קישורים כאלה נקראים פפטידים. ככל שיותר חומצות אמינו מצטרפות לשרשרת הגדלה הזו, השרשרת המתקבלת ידועה כפוליפפטיד. לכל פוליפפטיד יש קבוצת אמינו חופשית בקצה אחד. קצה זה נקרא מסוף N, או מסוף האמינו, ובקצה השני יש קבוצת קרבוקסיל חופשית, המכונה גם מסוף C או קרבוקסיל. בעוד שהמונחים פוליפפטיד וחלבון משמשים לעתים לסירוגין, פוליפפטיד הוא מבחינה טכנית פולימר של חומצות אמינו, בעוד שהמונח חלבון משמש לפוליפפטיד או פוליפפטידים שהתחברו יחד, לעתים קרובות קשרו קבוצות תותבות שאינן פפטידיות, בעלי צורה ברורה, ויש להם תפקיד ייחודי. לאחר סינתזת חלבון (תרגום), רוב החלבונים משתנים. אלה ידועים כשינויים שלאחר התרגום. הם עשויים לעבור מחשוף, זרחון, או עשויים לדרוש תוספת של קבוצות כימיות אחרות. רק לאחר שינויים אלה החלבון מתפקד לחלוטין.
חיבור אבולוציה
המשמעות האבולוציונית של ציטוכרום ccytochrome c הוא מרכיב חשוב בשרשרת הובלת האלקטרונים, חלק מהנשימה התאית, והוא נמצא בדרך כלל באברון התא, המיטוכונדריון. לחלבון זה יש קבוצה תותבת heme, והיון המרכזי של ההמה מצטמצם ומתחמצן לסירוגין במהלך העברת אלקטרונים. מכיוון שתפקידו של חלבון חיוני זה בייצור אנרגיה תאית הוא קריטי, הוא השתנה מעט מאוד במשך מיליוני שנים. רצף חלבונים הראה שיש כמות ניכרת של הומולוגיה של רצף חומצות אמינו ציטוכרום c בין מינים שונים; במילים אחרות, ניתן להעריך קרבה אבולוציונית על ידי מדידת הדמיון או ההבדלים בין רצפי ה- DNA או החלבון של מינים שונים.
מדענים קבעו כי ציטוכרום c אנושי מכיל 104 חומצות אמינו. עבור כל מולקולת ציטוכרום c מאורגניזמים שונים שעברו רצף עד כה, 37 מחומצות אמינו אלו מופיעות באותו מיקום בכל הדגימות של ציטוכרום ג זה מצביע על כך שאולי היה אב קדמון משותף. בהשוואת רצפי החלבון האנושי והשימפנזה, לא נמצא הבדל ברצף. כאשר הושוו רצפי קופים אנושיים ורזוס, ההבדל היחיד שנמצא היה בחומצת אמינו אחת. בהשוואה אחרת, רצף בין אדם לשמרים מראה הבדל במיקום ה -44.
מבנה חלבון
כפי שנדון קודם לכן, צורת החלבון היא קריטית לתפקודו. לדוגמה, אנזים יכול להיקשר למצע ספציפי באתר המכונה האתר הפעיל. אם אתר פעיל זה משתנה בגלל שינויים מקומיים או שינויים במבנה החלבון הכולל, ייתכן שהאנזים לא יוכל להיקשר למצע. כדי להבין כיצד החלבון מקבל את צורתו או הקונפורמציה הסופית שלו, עלינו להבין את ארבע הרמות של מבנה החלבון: ראשוני, משני, שלישוני ורבעוני.
מבנה ראשוני
הרצף הייחודי של חומצות אמינו בשרשרת פוליפפטיד הוא המבנה העיקרי שלה. לדוגמה, להורמון הלבלב אינסולין יש שתי שרשראות פוליפפטידיות, A ו- B, והן מקושרות זו לזו על ידי קשרי דיסולפיד. חומצת האמינו הסופנית N של שרשרת A היא גליצין, ואילו חומצת האמינו הסופית C היא אספרגין (איור
סיכום
חלבונים הם סוג של מקרומולקולות המבצעות מגוון רחב של פונקציות עבור התא. הם מסייעים בחילוף החומרים על ידי מתן תמיכה מבנית ועל ידי פעולה כאנזימים, נשאים או הורמונים. אבני הבניין של חלבונים (מונומרים) הם חומצות אמינו. לכל חומצת אמינו יש פחמן מרכזי המקושר לקבוצת אמינו, קבוצת קרבוקסיל, אטום מימן וקבוצת R או שרשרת צדדית. ישנן 20 חומצות אמינו נפוצות, שכל אחת מהן שונה בקבוצת R. כל חומצת אמינו מקושרת לשכנותיה על ידי קשר פפטיד. שרשרת ארוכה של חומצות אמינו ידועה כפוליפפטיד.
החלבונים מאורגנים בארבע רמות: ראשוני, משני, שלישוני ו (אופציונלי) רבעוני. המבנה העיקרי הוא הרצף הייחודי של חומצות אמינו. הקיפול המקומי של הפוליפפטיד ליצירת מבנים כמו סליל α ויריעה מקופלת β מהווה את המבנה המשני. המבנה התלת מימדי הכולל הוא המבנה השלישוני. כאשר שני פוליפפטידים או יותר מתחברים ליצירת מבנה החלבון המלא, התצורה ידועה כמבנה הרבעוני של חלבון. צורת החלבון ותפקודו מקושרים בצורה מורכבת; כל שינוי בצורה הנגרם משינויים בטמפרטורה או ב-pH עלול להוביל לדנטורציה של חלבון ולאובדן תפקוד.
חיבורי אמנות
איור\(\PageIndex{2}\): אילו קטגוריות של חומצת אמינו היית מצפה למצוא על פני השטח של חלבון מסיס, ואילו היית מצפה למצוא בפנים? איזו התפלגות של חומצות אמינו היית מצפה למצוא בחלבון המוטמע בשכבה דו-שומנית?
- תשובה
-
שאריות חומצות אמינו קוטביות וטעונות (השאר לאחר היווצרות קשר פפטיד) נוטות יותר להימצא על פני השטח של חלבונים מסיסים שבהם הם יכולים לקיים אינטראקציה עם מים, וסבירות גבוהה יותר להימצא לא קוטביות (למשל שרשראות צד של חומצות אמינו) ב פנים שבו הם מופרדים מהמים. בחלבוני ממברנה, שרשראות צד של חומצות אמינו לא קוטביות והידרופוביות מתחברות לזנבות ההידרופוביים של פוספוליפידים, בעוד שרשראות צד קוטביות וטעונות של חומצות אמינו מקיימות אינטראקציה עם קבוצות הראש הקוטביות או עם התמיסה המימית. עם זאת, ישנם יוצאים מן הכלל. לפעמים, שרשראות צד של חומצות אמינו טעונות חיוביות ושליליות מקיימות אינטראקציה זו עם זו בחלק הפנימי של חלבון, וניתן למצוא שרשראות צד קוטביות או טעונות של חומצות אמינו המקיימות אינטראקציה עם ליגנד בכיס קושר הליגנד.
רשימת מילים
- מבנה אלפא-סליל (α-helix)
- סוג המבנה המשני של חלבונים הנוצרים על ידי קיפול הפוליפפטיד לצורת סליל עם קשרי מימן המייצבים את המבנה
- חומצת אמינו
- מונומר של חלבון; יש פחמן מרכזי או פחמן אלפא שאליו מחוברת קבוצת אמינו, קבוצת קרבוקסיל, מימן וקבוצת R או שרשרת צדדית; קבוצת R שונה עבור כל 20 חומצות האמינו
- יריעת קפלי בטא (β -קפלים)
- מבנה משני המצוי בחלבונים בהם נוצרים "קפלים" על ידי קישור מימן בין אטומים על עמוד השדרה של שרשרת הפוליפפטיד
- מלווה
- (גם, צ'פרונין) חלבון המסייע לחלבון המתהווה בתהליך הקיפול
- דנטורציה
- אובדן צורה בחלבון כתוצאה משינויים בטמפרטורה, pH או חשיפה לכימיקלים
- אנזים
- זרז בתגובה ביוכימית שהיא בדרך כלל חלבון מורכב או מצומד
- הורמון
- מולקולת איתות כימית, בדרך כלל חלבון או סטרואידים, המופרשת על ידי תאים אנדוקריניים הפועלים לשליטה או ויסות תהליכים פיזיולוגיים ספציפיים
- קשר פפטיד
- קשר שנוצר בין שתי חומצות אמינו על ידי תגובת התייבשות
- פוליפפטיד
- שרשרת ארוכה של חומצות אמינו המקושרות על ידי קשרי פפטיד
- מבנה ראשוני
- רצף ליניארי של חומצות אמינו בחלבון
- חלבון
- מקרומולקולה ביולוגית המורכבת משרשרת אחת או יותר של חומצות אמינו
- מבנה רבעוני
- שיוך של יחידות משנה של פוליפפטיד בדידים בחלבון
- מבנה משני
- מבנה קבוע שנוצר על ידי חלבונים על ידי קשר מימן תוך מולקולרי בין אטום החמצן של שארית חומצת אמינו אחת לבין המימן המחובר לאטום החנקן של שארית חומצת אמינו אחרת
- מבנה שלישוני
- קונפורמציה תלת מימדית של חלבון, כולל אינטראקציות בין אלמנטים מבניים משניים; נוצר מאינטראקציות בין שרשראות צד של חומצות אמינו


