8.5: טרנסקריפטומיה
- Page ID
- 207772
שקול מטריצה המכילה את כל רצפי הגנים הידועים בגנום. כדי ליצור מטריצה כזו לניתוח, יהיה צורך ליצור עותקים של כל גן, בין אם על ידי סינתזה כימית או באמצעות תגובת שרשרת הפולימראז. לאחר מכן יופרדו גדילי ה-DNA המתקבלים כדי להשיג רצפים חד-גדיליים שניתן לחבר לשבב. כל תיבה של הרשת תכיל רצף מגן אחד. עם רשת זו, אפשר לנתח את התעתיק - כל ה-mRNA שנעשים בתאים נבחרים בזמן נתון. לניתוח פשוט, אפשר לקחת רקמה (נניח כבד) ולחלץ ממנה את כל ה-mRNA. אוכלוסיית mRNA זו מייצגת את כל הגנים שבאו לידי ביטוי בתאי הכבד בזמן חילוץ ה- RNA. RNAs אלה צריכים להיות מסוגלים להכליא (זוג בסיסים) עם הגנים המתאימים שלהם על המיקרו-מערך. לגנים שלא באו לידי ביטוי לא יהיו mRNA להיקשר לגנים המתאימים שלהם ברשת.
איור 8.25 - העתקה ותיוג של תעתיק. תמונה על ידי טרלין טאן
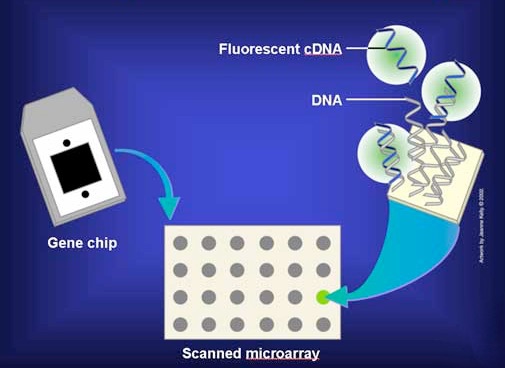
בפועל, ה-mRNA אינם בשימוש ישיר, אלא מועתקים לעותקי DNA חד-גדילי הנקראים cDNA. ה-cDNAs מתויגים בצבע פלואורסצנטי ומתווספים למיקרו-מערך בתנאים המאפשרים זיווג בסיסים כך שה-cDNAs יוכלו למצוא ולהתאים בסיס עם רצפים משלימים על המטריצה (איור 8.26). המטריצה נשטפת לאחר מכן כדי להסיר cDNAs לא הכלאיים. נוכחות/היעדר/שפע של כל mRNA נקבע לאחר מכן בקלות על ידי מדידת כמות הצבע בכל קופסה של הרשת.
איור 8.26 - הוסף cDNAs מסומנים לצלחת מיקרו-מערך. תמונה על ידי טרלין טאן
באיור 8.27, cDNA פלואורסצנטי נקשר למקום בקצה הימני בשורה השלישית של הרשת. המשמעות היא שרצף ה- cDNA היה משלים לרצף רצף הגנים המשותק בנקודה זו. מכיוון שזהות הגנים בכל מיקום ברשת ידועה, אנו יודעים אז שהדגימה הכילה mRNA שתואם לגן המסוים הזה. במילים אחרות, הגן הזה בא לידי ביטוי בתאים שמהם התקבלו ה-mRNA.
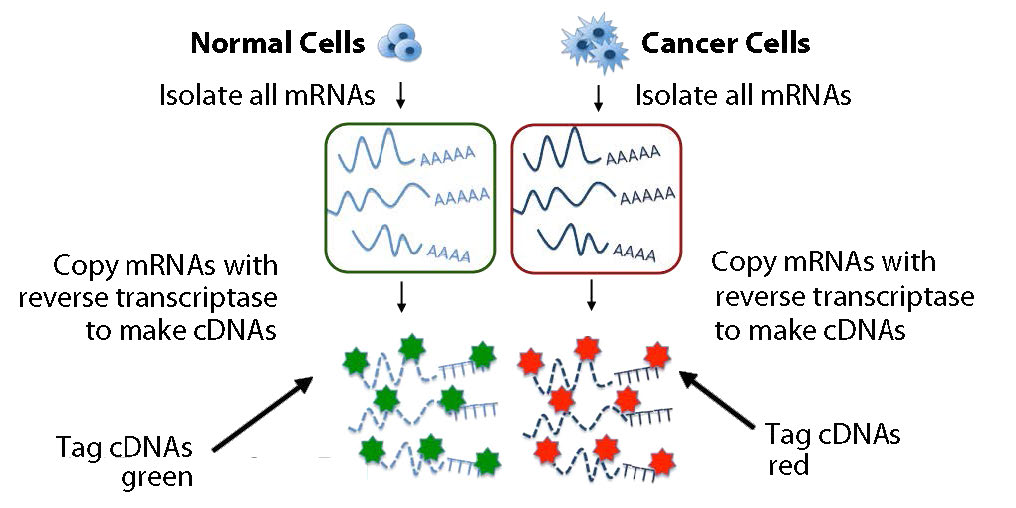
ניתוח חזק יותר יכול להתבצע עם שתי קבוצות של mRNA בו זמנית. קבוצה אחת של cDNAs יכולה להגיע מרקמה סרטנית והשנייה מרקמה לא סרטנית, למשל. ה-cDNAs שמקורם בכל דגימה מסומנים בצבע שונה (נניח ירוק לנורמלי ואדום לסרטן) (איור 8.25). ה-cDNAs מעורבבים ולאחר מכן מתווספים למטריצה ורצפים משלימים מורשים שוב ליצור דופלקסים (איור 8.27).
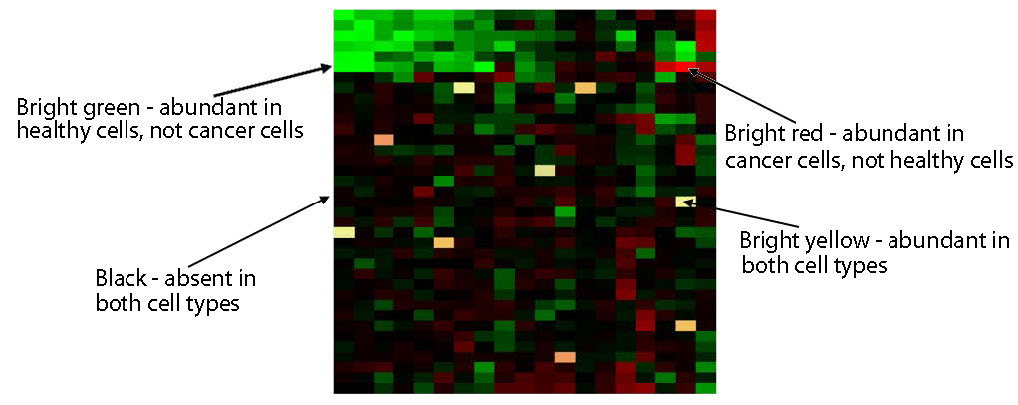
איור 8.28 - ניתוח מיקרו-מערך המשווה ביטוי גנים בתאים נורמליים ובתאים סרטניים. ויקיפדיה
cDNAs לא היברידיים נשטפים ואז הצלחת מנותחת. קופסאות רשת אדומות מתאימות ל-mRNA הקיים ברקמה הסרטנית, אך לא ברקמה הלא סרטנית. קופסאות רשת ירוקות מתאימות ל-mRNA הקיים ברקמה הלא סרטנית, אך לא ברקמה הסרטנית. צהוב יתאים ל-mRNA הקיימים בשפע שווה בשתי הרקמות (איור 8.28). העוצמה של כל נקודה נותנת גם מידע על הכמויות היחסיות של כל mRNA בכל רקמה.

איור 8.29 - רצף אוטומטי של תפוקה גבוהה. ויקיפדיה
ניתן להתאים את אותו עיקרון המשמש למיקרו מערכי חומצות גרעין לניתוח מולקולות אחרות. לדוגמה, פוליפפטידים יכולים להיות קשורים לשקופית הזכוכית במקום DNA כדי ליצור שבב חלבון. שבבי חלבון שימושיים לחקר האינטראקציות של חלבונים עם מולקולות אחרות וכן לאבחון.
טכניקת RNA-seq
בדומה למיקרו-מערכים, שיטה חדשה יותר הנקראת RNA-seq, היא כלי לאיתור וכימות בו זמנית של כל התמלילים במדגם נתון. שיטה זו מסתמכת על טכנולוגיות רצף שפותחו לאחרונה הנקראות רצף הדור הבא, או רצף עמוק. טכניקות אלה מאפשרות רצף מהיר ומקביל של מיליוני שברי DNA, ולכן ניתן להשתמש בהן לא רק עבור DNA גנומי, אלא גם לרצף את כל ה- RNA המתועתק לאחור מדגימה נתונה.
כדי לקבוע את כל הגנים המקודדים לחלבון שהתבטאו בקבוצה מסוימת של תאים בתנאים פיזיולוגיים ספציפיים, כל ה-mRNA יופק תחילה ויועתק לאחור ל-cDNA. שלב זה דומה להכנת דגימות עבור microarrays. עם זאת, בשלב זה, ה-cDNAs מפוצלים לחתיכות קטנות יותר, ויש להם מתאמי רצף קטנים מחוברים משני קצותיו. לאחר מכן, השברים נתונים לרצף בתפוקה גבוהה, כדי להשיג רצפים קצרים מכל השברים. נתונים אלה מיושרים מול רצף הגנום ומשמשים למדידת רמת הביטוי של גנים שונים. RNA-seq מציע כמה יתרונות על פני מיקרו מערכים. בעזרת מיקרו-מערכים, ניתן לזהות RNA רק אם רצף הגנים המתאים לו קיים ברשת. ב- RNA-seq כל RNA הקיים בדגימה הוא ברצף, כך שזיהוי RNAs אינו מוגבל על ידי הבדיקות על שבב. RNA-seq רגיש יותר ממיקרו-מערכים ומציע טווח גדול בהרבה שעליו ניתן למדוד את ביטוי הגנים במדויק.

