17.1: Isótopos radioativos
- Page ID
- 172614
Lembre-se de que um átomo é o menor componente de um elemento que retém todas as propriedades químicas desse elemento (veja Matéria). Conforme discutido anteriormente, os átomos contêm nêutrons não carregados e prótons com carga positiva no núcleo. Elétrons carregados negativamente cercam o núcleo. A massa atômica de um átomo é determinada pelo número de prótons e nêutrons porque a massa dos elétrons é insignificante. Cada próton ou nêutron pesa 1 unidade de massa atômica (AMU). Os valores de massa atômica exibidos na tabela periódica dos elementos não são números inteiros porque representam a massa atômica média dos átomos desse elemento (figura\(\PageIndex{a}\)). Átomos do mesmo elemento não têm necessariamente a mesma massa porque podem diferir no número de nêutrons.
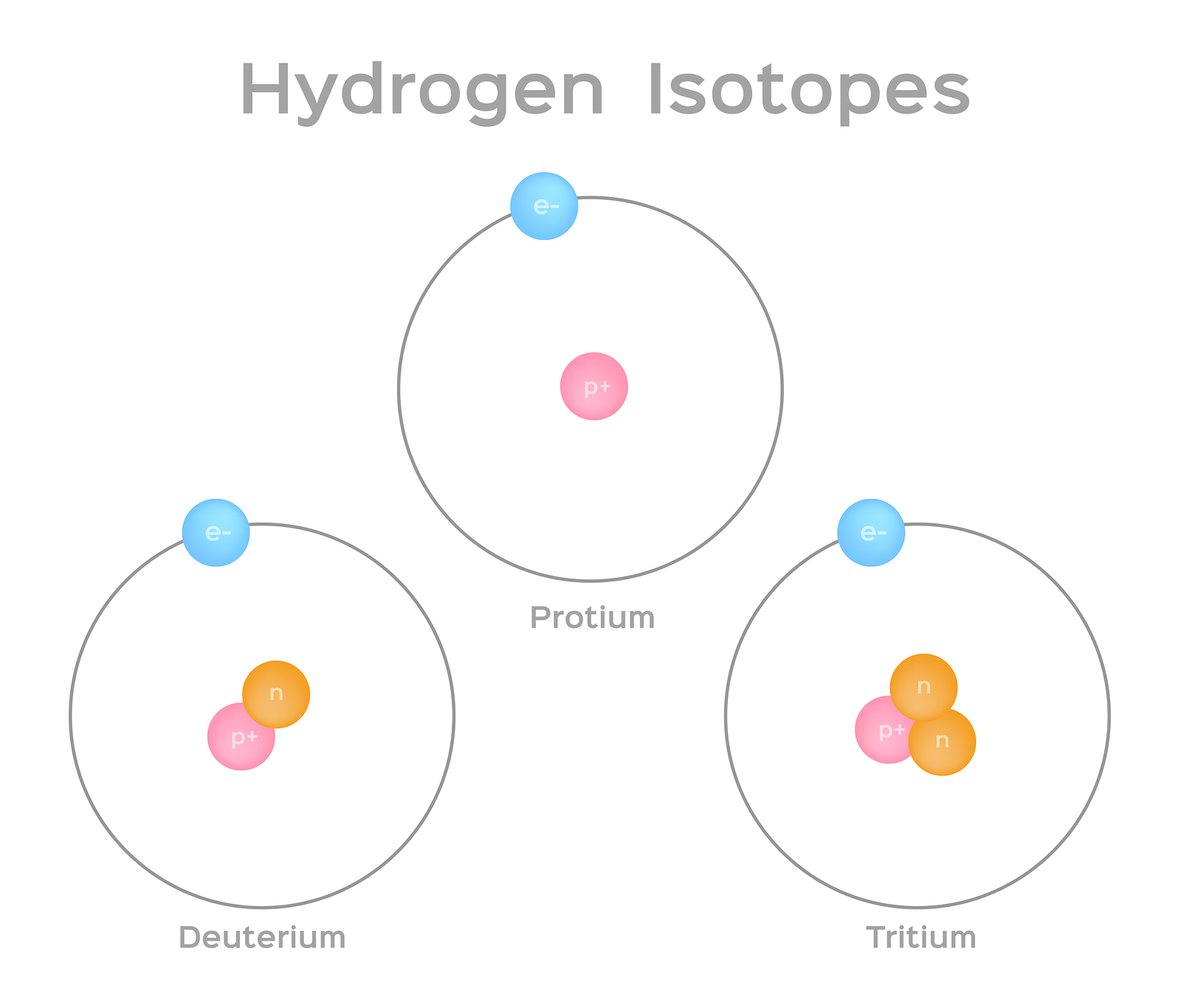
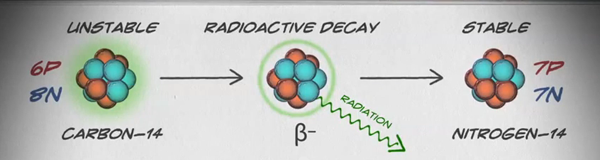
Isótopos são formas diferentes do mesmo elemento que têm o mesmo número de prótons, mas um número diferente de nêutrons. Alguns elementos, como carbono, potássio e urânio, têm isótopos naturais. O carbono-12, o isótopo mais comum de carbono, contém seis prótons e seis nêutrons. Portanto, ele tem um número de massa de 12 (seis prótons e seis nêutrons) e um número atômico de 6 (o que o torna carbono). O carbono-14 contém seis prótons e oito nêutrons. Portanto, tem um número de massa de 14 (seis prótons e oito nêutrons) e um número atômico de 6, o que significa que ainda é o elemento carbono. Essas duas formas alternativas de carbono são isótopos. Alguns isótopos são instáveis e emitem radiação na forma de partículas e energia para formar elementos mais estáveis. Algumas formas de radiação são perigosas. Eles são chamados de isótopos radioativos ou radioisótopos (figura\(\PageIndex{b}\)). Durante o decaimento radioativo, um tipo de átomo pode se transformar em outro tipo de átomo dessa maneira (figura\(\PageIndex{c}\)).
Meia-vida
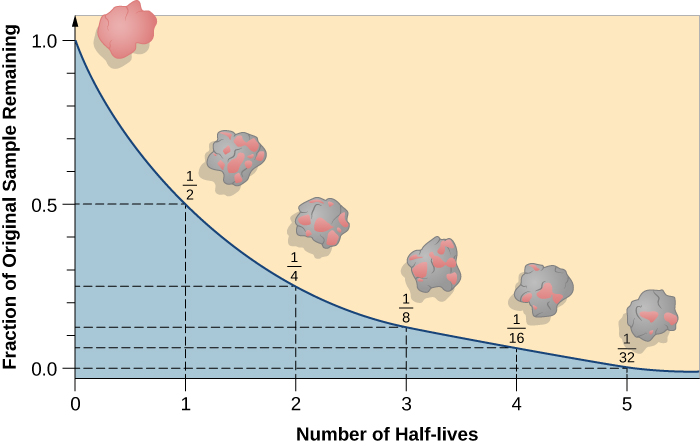
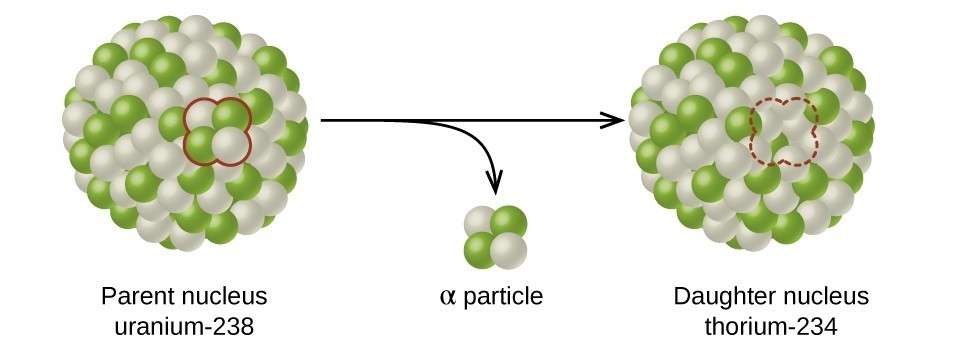
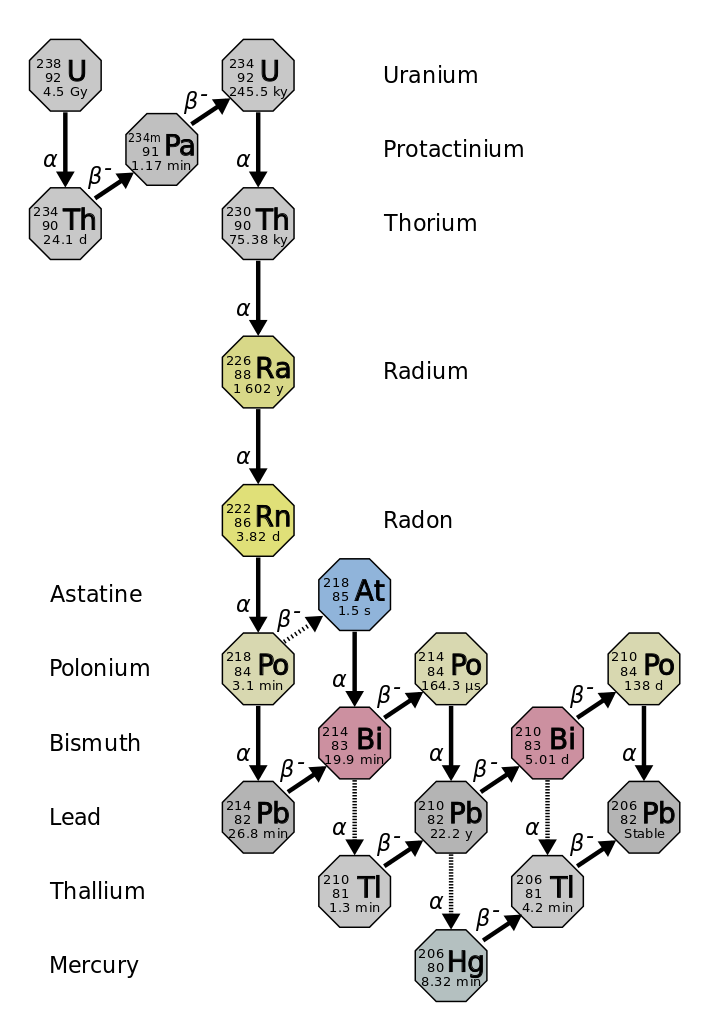
A meia-vida é a quantidade de tempo que a metade do isótopo radioativo original leva para se decompor (figura\(\PageIndex{d}\)). Por exemplo, a meia-vida do urânio-238 é de cerca de 4,5 bilhões de anos. Após 4,5 bilhões de anos, apenas metade (50%) da quantidade original de urânio-238 permanecerá. O resto terá decaído para tório-234 (que também é radioativo e decai rapidamente em uma série de isótopos radioativos, até que finalmente se torne chumbo-206, que é estável; figura\(\PageIndex{e-f}\)). Depois de duas meias-vidas (9 bilhões de anos), apenas metade dos 50% permaneceria (25% do original). Depois de três meias-vidas, apenas 12,5% do urânio-238 original permaneceria.
Evolução em ação: Datação por carbono
O carbono-14 (14 C) é um radioisótopo natural criado na atmosfera por raios cósmicos. Esse é um processo contínuo, então mais 14 C estão sempre sendo criados. Conforme um organismo vivo se desenvolve, o nível relativo de 14 C em seu corpo é igual à concentração de 14C na atmosfera. Quando um organismo morre, ele não está mais ingerindo 14 C, então a proporção diminuirá. 14 C decai para 14 N por um processo chamado decaimento beta; ele emite energia nesse processo lento (figura\(\PageIndex{c}\)). Após aproximadamente 5.730 anos, apenas metade da concentração inicial de 14 C terá sido convertida em 14 N. O tempo necessário para que metade da concentração original de um isótopo decaia para sua forma mais estável é chamado de meia-vida.
Como a meia-vida de 14 C é longa, ela é usada para envelhecer objetos anteriormente vivos, como fósseis. Usando a razão entre a concentração de 14 C encontrada em um objeto e a quantidade de 14 C detectada na atmosfera, a quantidade do isótopo que ainda não se decompôs pode ser determinada. Com base nessa quantidade, a idade do fóssil pode ser calculada em cerca de 50.000 anos (figura\(\PageIndex{g}\) abaixo). Isótopos com meia-vida mais longa, como o potássio-40, são usados para calcular a idade de fósseis mais antigos. Por meio do uso da datação por carbono, os cientistas podem reconstruir a ecologia e a biogeografia dos organismos que vivem nos últimos 50.000 anos.
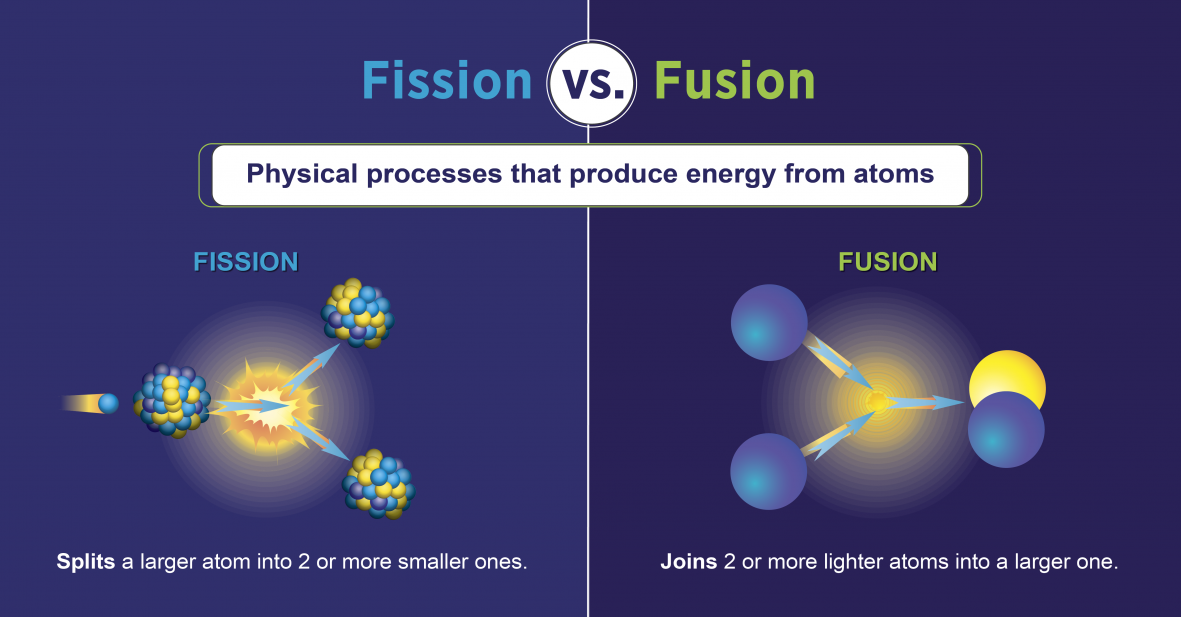
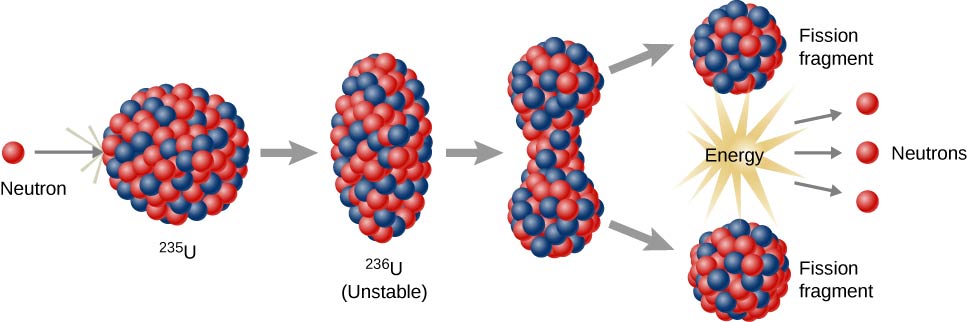
Reações de fissão nuclear
As reações de fissão nuclear são aquelas que envolvem a divisão do núcleo de um átomo (figura\(\PageIndex{h}\)). Eles podem ser induzidos pela explosão de elementos radioativos com nêutrons. Tal como acontece com o decaimento radioativo natural, as reações de fissão nuclear induzidas liberam energia. A energia térmica liberada durante a fissão nuclear pode ser usada para gerar eletricidade. Essa é a base da energia nuclear. Atualmente, o urânio-235 (235 U; um isótopo de urânio com uma massa atômica de 235) é usado atualmente como combustível para reações de fissão nuclear (figura\(\PageIndex{h}\)).