19.3 : Propriétés optiques et magnétiques des composés de coordination
- Page ID
- 194007
- Décrire les prémisses de base de la théorie des champs cristallins (CFT)
- Identifier les géométries moléculaires associées à divers modèles de division de l'orbite D
- Prédire les configurations électroniques des orbitales d divisées pour des atomes ou des ions de métaux de transition sélectionnés
- Expliquer les propriétés spectrales et magnétiques en termes de concepts CFT
Le comportement des composés de coordination ne peut pas être expliqué de manière adéquate par les mêmes théories que celles utilisées pour la chimie des éléments du groupe principal. Les géométries observées des complexes de coordination ne sont pas compatibles avec les orbitales hybridées sur le métal central chevauchant les orbitales des ligands, comme le prédit la théorie des liaisons de valence. Les couleurs observées indiquent que les orbitales d se produisent souvent à des niveaux d'énergie différents au lieu d'être toutes dégénérées, c'est-à-dire d'énergie égale, comme le sont les trois orbitales p. Pour expliquer les stabilités, les structures, les couleurs et les propriétés magnétiques des complexes de métaux de transition, un modèle de liaison différent a été développé. Tout comme la théorie des liaisons de valence explique de nombreux aspects de la liaison dans la chimie des principaux groupes, la théorie des champs cristallins est utile pour comprendre et prédire le comportement des complexes de métaux de transition.
Théorie des champs crist
Pour expliquer le comportement observé des complexes de métaux de transition (comme la façon dont les couleurs apparaissent), un modèle impliquant des interactions électrostatiques entre les électrons des ligands et les électrons des orbitales d non hybridées de l'atome métallique central a été développé. Ce modèle électrostatique est la théorie des champs cristallins (CFT). Il nous permet de comprendre, d'interpréter et de prédire les couleurs, le comportement magnétique et certaines structures des composés de coordination des métaux de transition.
La CFT se concentre sur les électrons non liés à l'ion métallique central dans des complexes de coordination et non sur les liaisons métal-ligand. Comme la théorie des liaisons de valence, la CFT ne raconte qu'une partie de l'histoire du comportement des complexes. Cependant, il indique à la partie que la théorie des liaisons de valence ne le fait pas. Dans sa forme pure, le CFT ignore toute liaison covalente entre les ligands et les ions métalliques. Le ligand et le métal sont traités comme des charges ponctuelles infinitésimales.
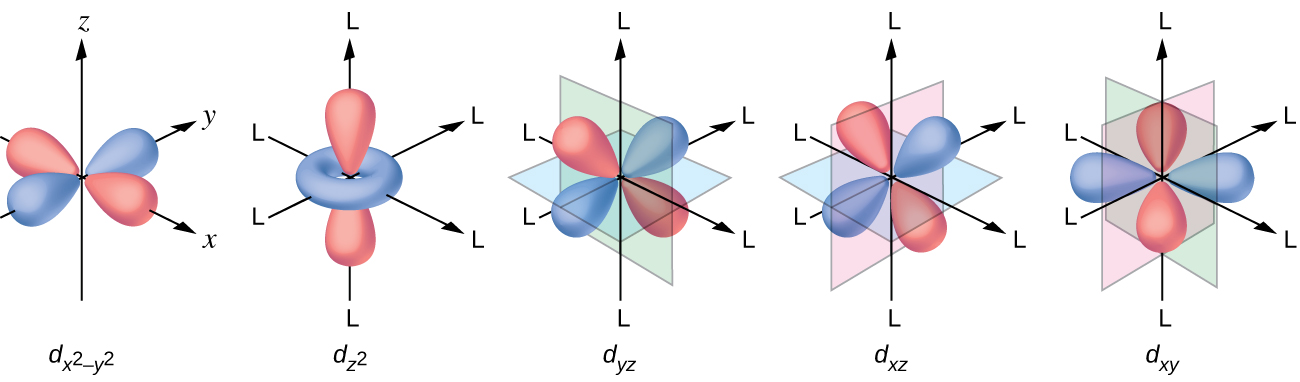
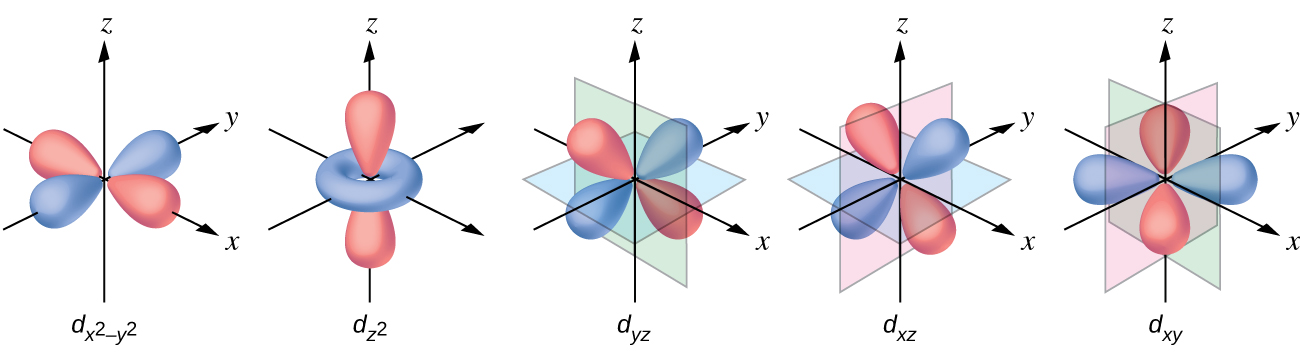
Tous les électrons étant négatifs, les électrons donnés par les ligands repousseront les électrons du métal central. Examinons le comportement des électrons dans les orbitales d non hybridées d'un complexe octaédrique. Les cinq orbitales d sont constituées de régions en forme de lobe et sont disposées dans l'espace, comme le montre la figure\(\PageIndex{1}\). Dans un complexe octaédrique, les six ligands se coordonnent le long des axes.
Dans un ion métallique non complexé en phase gazeuse, les électrons sont répartis sur les cinq orbitales d conformément à la règle de Hund, car les orbitales ont toutes la même énergie. Cependant, lorsque les ligands se coordonnent avec un ion métallique, les énergies des orbitales d ne sont plus les mêmes.
Dans les complexes octaédriques, les lobes de deux des cinq orbitales d, les\(d_{x^2−y^2}\) orbitales\(d_{z^2}\) et, pointent vers les ligands (Figure\(\PageIndex{1}\)). Ces deux orbitales sont appelées orbitales e g (le symbole fait en fait référence à la symétrie des orbitales, mais nous l'utiliserons comme nom pratique pour ces deux orbitales dans un complexe octaédrique). Les trois autres orbitales, les orbitales d xy, d xz et d yz, ont des lobes pointant entre les ligands et sont appelées orbitales t 2 g (encore une fois, le symbole fait vraiment référence à à la symétrie des orbitales). Lorsque six ligands s'approchent de l'ion métallique le long des axes de l'octaèdre, leurs charges ponctuelles repoussent les électrons sur les orbitales d de l'ion métallique. Cependant, les répulsions entre les électrons des orbitales e g (les\(d_{z^2}\)\(d_{x^2−y^2}\) orbitales et) et les ligands sont supérieures aux répulsions entre les électrons des orbitales t 2 g (le d zy, d, xz et d yz (orbitales) et les ligands. En effet, les lobes des orbitales e g pointent directement vers les ligands, tandis que les lobes des orbitales t 2 g pointent entre eux. Ainsi, les électrons des orbitales e g de l'ion métallique d'un complexe octaédrique ont des énergies potentielles plus élevées que celles des électrons des orbitales t 2 g. La différence d'énergie peut être représentée comme indiqué sur la figure\(\PageIndex{2}\).
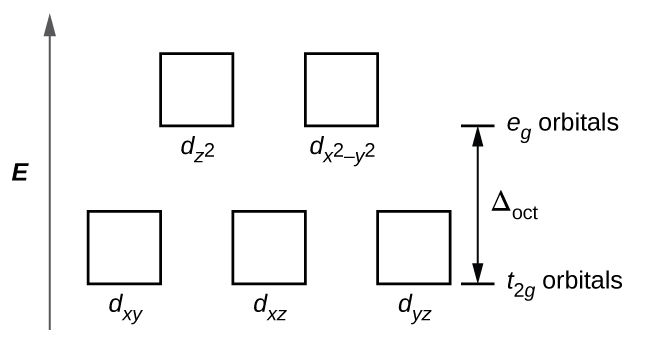
La différence d'énergie entre les orbitales e g et t 2 g est appelée division du champ cristallin et est symbolisée par Δoct, où oct signifie octaédrique.
L'amplitude de Δ oct dépend de nombreux facteurs, notamment de la nature des six ligands situés autour de l'ion métallique central, de la charge sur le métal et du fait que le métal utilise des orbitales 3D, 4d ou 5d. Différents ligands produisent différentes divisions du champ cristallin. La division croissante du champ cristallin produite par les ligands est exprimée dans la série spectrochimique, dont une version courte est donnée ici :
\[\large \underset{\textrm{a few ligands of the spectrochemical series, in order of increasing field strength of the ligand}}{\xrightarrow{\ce{I- <Br- <Cl- <F- <H2O<C2O4^2- <NH3<\mathit{en}<NO2- <CN-}}} \nonumber \]
Dans cette série, les ligands de gauche provoquent de petites divisions de champ cristallin et sont des ligands de champ faible, tandis que ceux de droite provoquent des divisions plus importantes et sont des ligands à champ fort. Ainsi, la valeur Δ oct pour un complexe octaédrique avec des ligands iodures (I −) est bien inférieure à la valeur Δ oct pour le même métal avec des ligands cyanures (CN −).
Les électrons des orbitales d suivent le principe aufbau (« remplissage »), selon lequel les orbitales seront remplies pour donner l'énergie totale la plus faible, tout comme dans la chimie des principaux groupes. Lorsque deux électrons occupent la même orbitale, les mêmes charges se repoussent. L'énergie nécessaire pour jumeler deux électrons sur une seule orbitale est appelée énergie d'appariement (P). Les électrons occuperont toujours individuellement chaque orbitale d'un ensemble dégénéré avant l'appariement. P a une amplitude similaire à Δ oct. Lorsque des électrons remplissent les orbitales d, les magnitudes relatives de Δ oct et P déterminent quelles orbitales seront occupées.
Dans le [Fe (CN) 6] 4−, le champ puissant de six ligands cyanurés produit un Δ oct important. Dans ces conditions, les électrons ont besoin de moins d'énergie pour s'apparier que pour être excités vers les orbitales, par exemple (Δ oct > P). Les six électrons 3D de la paire d'ions Fe 2 + sur les trois orbitales t 2 g (Figure\(\PageIndex{3}\)). Les complexes dans lesquels les électrons sont appariés en raison de la grande division du champ cristallin sont appelés complexes à faible spin, car le nombre d'électrons non appariés (spins) est minimisé.
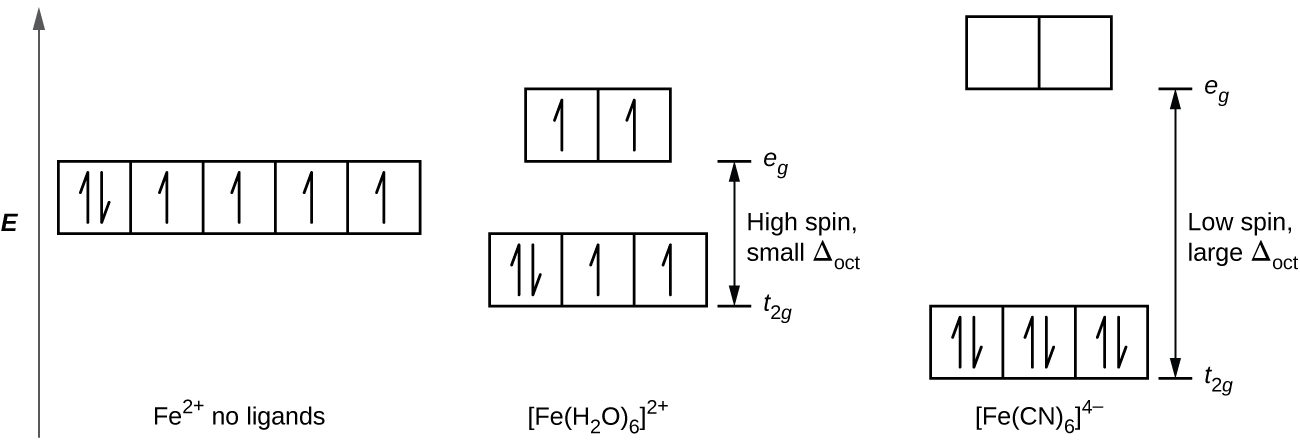
Dans le [Fe (H 2 O) 6] 2+, en revanche, le champ faible des molécules d'eau ne produit qu'une petite division du champ cristallin (Δ oct < P). Comme les électrons ont besoin de moins d'énergie pour occuper les orbitales, par exemple, que pour s'apparier, il y aura un électron dans chacune des cinq orbitales 3D avant que l'appariement ne se produise. Pour les six électrons d sur le centre du fer (II) dans [Fe (H 2 O) 6] 2+, il y aura une paire d'électrons et quatre électrons non appariés (Figure\(\PageIndex{3}\)). Les complexes tels que l'ion [Fe (H 2 O) 6] 2+, dans lesquels les électrons ne sont pas appariés parce que la division du champ cristallin n'est pas assez importante pour provoquer leur appariement, sont appelés complexes à spin élevé parce que le nombre d'électrons non appariés (spins) est maximisé.
Un raisonnement similaire montre pourquoi l'ion [Fe (CN) 6] 3− est un complexe à faible spin comportant un seul électron non apparié, alors que les ions [Fe (H 2 O) 6] 3+ et [FeF 6] 3− sont des complexes à spin élevé comportant cinq électrons non appariés.
Prédisez le nombre d'électrons non appariés.
- K 3 [CRi 6]
- [Cu (fr) 2 (H 2 O) 2] Cl 2
- Na 3 [Co (NO 2) 6]
Solution
Les complexes sont octaédriques.
- Cr 3 + a une configuration d 3. Ces électrons ne seront pas tous appariés.
- Cu 2 + est d 9, donc il y aura un électron non apparié.
- Le Co 3 + possède des électrons de valence d 6, de sorte que la division du champ cristallin déterminera le nombre d'électrons appariés. Le nitrite étant un ligand à champ fort, le complexe aura un spin faible. Six électrons passeront dans les orbitales t 2 g, laissant 0 non appariés.
La taille de la division du champ cristallin n'influence la disposition des électrons que lorsqu'il est possible de choisir entre apparier des électrons et remplir les orbitales de plus haute énergie. Pour quelles configurations d'électrons d existera-t-il une différence entre les configurations à spin élevé et faible dans les complexes octaédriques ?
- Réponse
-
d 4, d 5, d 6 et d 7
La CFT est applicable à des molécules de géométries autres que octaédriques. Dans les complexes octaédriques, rappelez-vous que les lobes de la consigne e g pointent directement sur les ligands. Pour les complexes tétraédriques, les orbitales d restent en place, mais nous n'avons plus que quatre ligands situés entre les axes (Figure\(\PageIndex{4}\)). Aucune des orbitales ne pointe directement vers les ligands tétraédriques. Cependant, l'ensemble e g (le long des axes cartésiens) chevauche moins les ligands que l'ensemble t 2 g. Par analogie avec le cas octaédrique, prédisez le diagramme énergétique des orbitales d dans un champ cristallin tétraédrique. Pour éviter toute confusion, l'ensemble e g octaédrique devient un ensemble e tétraédrique et l'ensemble t 2 g octaédrique devient un ensemble t 2.
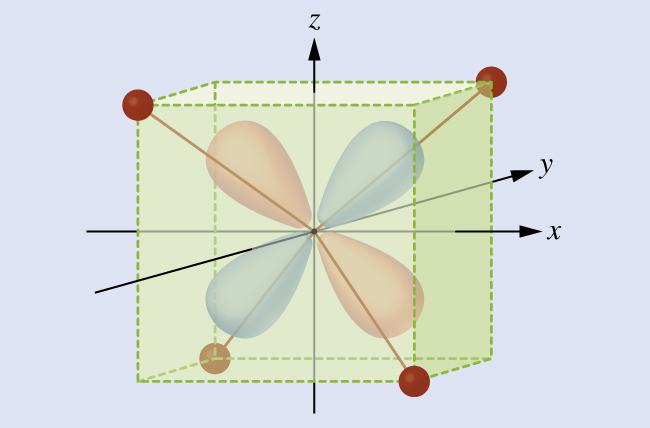
Solution
La CFT étant basée sur la répulsion électrostatique, les orbitales les plus proches des ligands seront déstabilisées et augmenteront en énergie par rapport à l'autre ensemble d'orbitales. La division est moindre que pour les complexes octaédriques car le chevauchement est moindre, donc Δ tet est généralement faible\(\left(Δ_\ce{tet}=\dfrac{4}{9}Δ_\ce{oct}\right)\) :
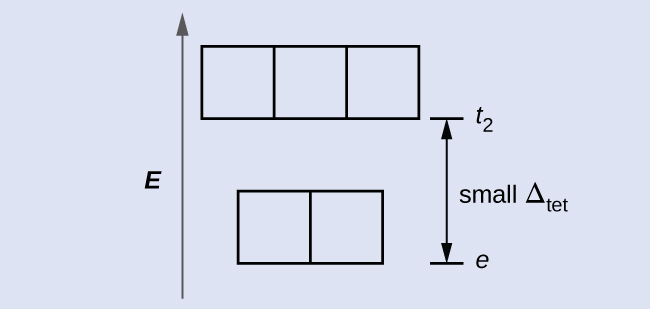
Expliquez le nombre d'électrons non appariés que comportera un ion tétraédrique d 4.
- Réponse
-
4 ; comme Δ tet est petit, tous les complexes tétraédriques ont un spin élevé et les électrons entrent dans les orbitales t 2 avant l'appariement
L'autre géométrie courante est carrée et plane. Il est possible de considérer une géométrie plane carrée comme une structure octaédrique avec une paire de ligands trans retirés. Les ligands retirés sont supposés se trouver sur l'axe z. Cela modifie la distribution des orbitales d, à mesure que les orbitales situées sur ou à proximité de l'axe z deviennent plus stables et que celles situées sur ou à proximité des axes x ou y deviennent moins stables. Il en résulte une division des ensembles octaédriques t 2 g et e g et donne un motif plus complexe sans un simple Δ oct. Le schéma de base est le suivant :
Moments magnétiques des molécules et des ions
Des preuves expérimentales de mesures magnétiques soutiennent la théorie des complexes à spin élevé et faible. N'oubliez pas que les molécules telles que l'O 2 qui contiennent des électrons non appariés sont paramagnétiques. Les substances paramagnétiques sont attirées par les champs magnétiques. De nombreux complexes de métaux de transition contiennent des électrons non appariés et sont donc paramagnétiques. Les molécules telles que le N 2 et les ions tels que Na + et [Fe (CN) 6] 4− qui ne contiennent pas d'électrons non appariés sont diamagnétiques. Les substances diamagnétiques ont légèrement tendance à être repoussées par les champs magnétiques.
Lorsqu'un électron d'un atome ou d'un ion n'est pas apparié, le moment magnétique dû à son spin rend l'atome ou l'ion entier paramagnétique. La taille du moment magnétique d'un système contenant des électrons non appariés est directement liée au nombre de ces électrons : plus le nombre d'électrons non appariés est élevé, plus le moment magnétique est important. Par conséquent, le moment magnétique observé est utilisé pour déterminer le nombre d'électrons non appariés présents. Le moment magnétique mesuré du d 6 [Fe (CN) 6] 4− à faible spin confirme que le fer est diamagnétique, tandis que le d 6 [Fe (H 2 O) 6] 2+ à spin élevé possède quatre électrons non appariés avec un moment magnétique qui confirme cet arrangement.
Couleurs des complexes de métaux de transition
Lorsque les atomes ou les molécules absorbent la lumière à la fréquence appropriée, leurs électrons sont excités vers des orbitales de plus haute énergie. Pour de nombreux atomes et molécules du groupe principal, les photons absorbés se situent dans la gamme ultraviolette du spectre électromagnétique, ce qui ne peut être détecté par l'œil humain. Pour les composés de coordination, la différence d'énergie entre les orbitales d permet souvent d'absorber les photons du domaine visible.
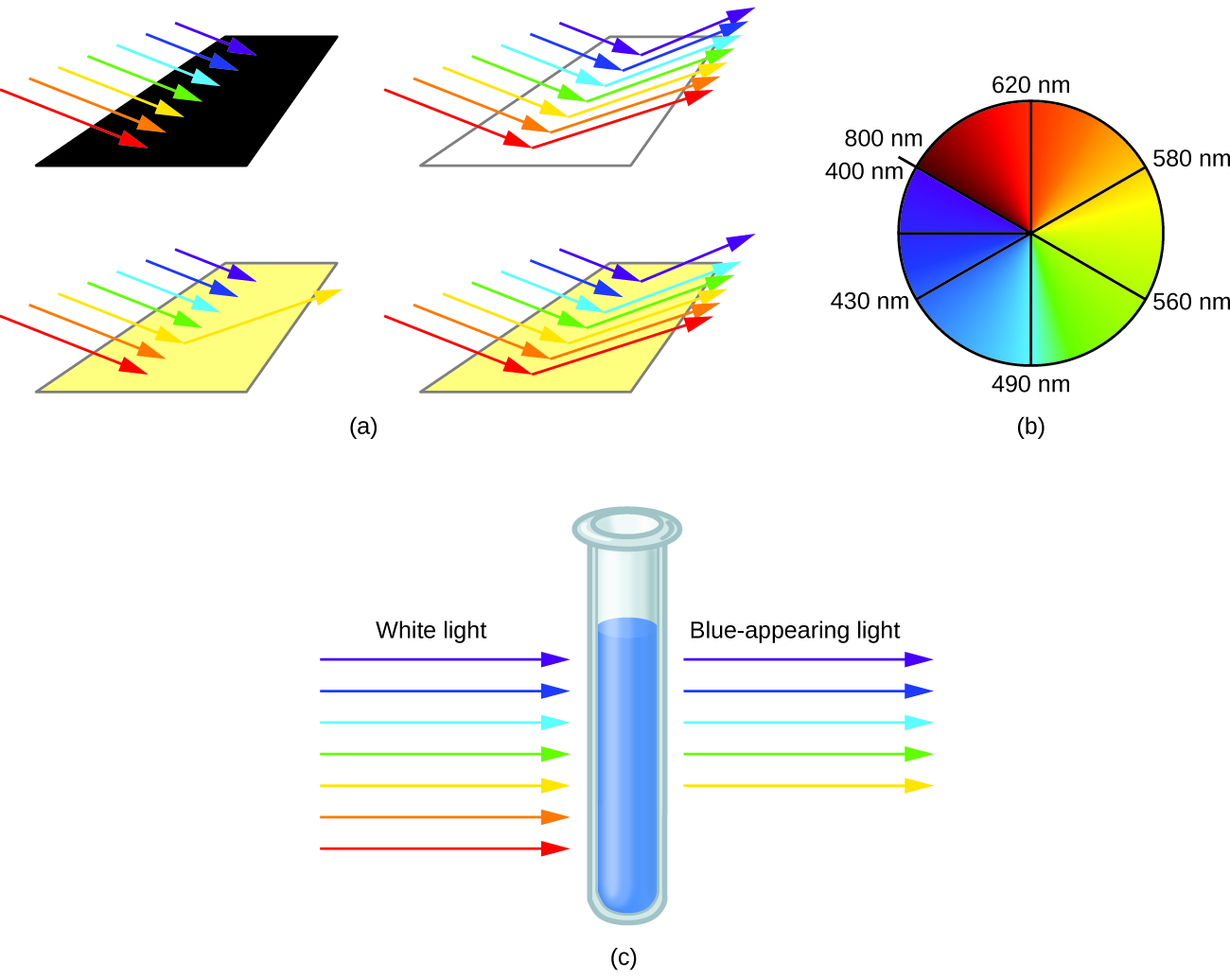
L'œil humain perçoit un mélange de toutes les couleurs, dans les proportions présentes dans la lumière solaire, comme de la lumière blanche. Les couleurs complémentaires, celles situées l'une en face de l'autre sur une roue chromatique, sont également utilisées dans la vision des couleurs. L'œil perçoit un mélange de deux couleurs complémentaires, dans les bonnes proportions, sous forme de lumière blanche. De même, lorsqu'une couleur est absente de la lumière blanche, l'œil voit son complément. Par exemple, lorsque les photons rouges sont absorbés par la lumière blanche, les yeux voient la couleur verte. Lorsque les photons violets sont retirés de la lumière blanche, les yeux voient du jaune citron. La couleur bleue de l'ion [Cu (NH 3) 4] 2+ est due au fait que cet ion absorbe la lumière orange et rouge, laissant les couleurs complémentaires du bleu et du vert (Figure\(\PageIndex{5}\)).
Le complexe octaédrique [Ti (H 2 O) 6] 3+ possède un seul électron d. Pour exciter cet électron de l'état fondamental t 2 g à l'orbitale e g, ce complexe absorbe la lumière de 450 à 600 nm. L'absorbance maximale correspond à Δ oct et se produit à 499 nm. Calculez la valeur de Δ oct en joules et prédisez de quelle couleur la solution apparaîtra.
Solution
À l'aide de l'équation de Planck (voir la section sur l'énergie électromagnétique), nous calculons :
\[v=\dfrac{c}{λ}\mathrm{\:so\:\dfrac{3.00×10^8\: m/s}{\dfrac{499\: nm×1\: m}{10^9\:nm}}=6.01×10^{14}\:Hz} \nonumber \]
\[E=hnu\mathrm{\:so\:6.63×10^{−34}\:\textrm{J⋅s}×6.01×10^{14}\:Hz=3.99×10^{−19}\:Joules/ion} \nonumber \]
Comme le complexe absorbe 600 nm (orange) à 450 (bleu), les longueurs d'onde indigo, violet et rouge seront transmises et le complexe apparaîtra violet.
Un complexe qui apparaît en vert, absorbe les photons de quelles longueurs d'onde ?
- Réponse
-
rouge, 620-800 nm
De petites variations des énergies relatives des orbitales entre lesquelles les électrons font la transition peuvent entraîner des changements drastiques de la couleur de la lumière absorbée. Par conséquent, les couleurs des composés de coordination dépendent de nombreux facteurs. Comme le montre la figure\(\PageIndex{6}\), différents ions métalliques aqueux peuvent avoir différentes couleurs. De plus, différents états d'oxydation d'un métal peuvent produire différentes couleurs, comme indiqué pour les complexes de vanadium dans le lien ci-dessous.

Les ligands spécifiques coordonnés au centre métallique influencent également la couleur des complexes de coordination. Par exemple, le complexe de fer (II) [Fe (H 2 O) 6] SO 4 apparaît bleu-vert parce que le complexe à spin élevé absorbe les photons dans les longueurs d'onde rouges (Figure\(\PageIndex{7}\)). En revanche, le complexe de fer (II) K 4 [Fe (CN) 6] à faible spin apparaît en jaune pâle parce qu'il absorbe les photons violets de plus haute énergie.

En général, les ligands à champ fort provoquent une division importante des énergies des orbitales d de l'atome de métal central (grand Δ oct). Les composés de coordination des métaux de transition avec ces ligands sont jaunes, oranges ou rouges car ils absorbent la lumière violette ou bleue à haute énergie. D'autre part, les composés de coordination des métaux de transition avec des ligands à champ faible sont souvent bleu-vert, bleu ou indigo parce qu'ils absorbent la lumière jaune, orange ou rouge à faible énergie.
Un composé de coordination de l'ion Cu + a une configuration d 10, et toutes les orbitales e g sont remplies. Pour exciter un électron à un niveau supérieur, tel que l'orbitale 4p, des photons de très haute énergie sont nécessaires. Cette énergie correspond à de très courtes longueurs d'onde dans la région ultraviolette du spectre. Aucune lumière visible n'est absorbée, donc l'œil ne voit aucun changement et le composé apparaît blanc ou incolore. Une solution contenant du [Cu (CN) 2] −, par exemple, est incolore. D'autre part, les complexes octaédriques de Cu 2 + présentent une lacune dans les orbitales, par exemple, et les électrons peuvent être excités à ce niveau. La longueur d'onde (énergie) de la lumière absorbée correspond à la partie visible du spectre, et les complexes de Cu 2 + sont presque toujours colorés : bleu, bleu-vert, violet ou jaune (Figure\(\PageIndex{8}\)). Bien que la CFT décrive avec succès de nombreuses propriétés des complexes de coordination, des explications de l'orbite moléculaire (au-delà du cadre d'introduction fourni ici) sont nécessaires pour comprendre pleinement le comportement des complexes de coordination.

Résumé
La théorie des champs cristallins traite les interactions entre les électrons du métal et les ligands comme un simple effet électrostatique. La présence des ligands à proximité de l'ion métallique modifie les énergies des orbitales du métal d par rapport à leurs énergies dans l'ion libre. La couleur et les propriétés magnétiques d'un complexe peuvent être attribuées à cette division du champ cristallin. L'amplitude du clivage (Δ oct) dépend de la nature des ligands liés au métal. Les ligands à champ fort produisent de grandes divisions et favorisent les complexes à faible spin, dans lesquels les orbitales t 2 g sont complètement remplies avant que des électrons n'occupent les orbitales e. g. Les ligands à champ faible favorisent la formation de complexes à spin élevé. Les orbitales t 2 g et e g sont occupées individuellement avant qu'aucune ne soit doublement occupée.
Lexique
- division du champ cristallin (Δ oct)
- différence d'énergie entre les ensembles t 2 g et e g ou les ensembles d'orbitales t et e
- théorie du champ cristallin
- modèle qui explique les énergies des orbitales dans les métaux de transition en termes d'interactions électrostatiques avec les ligands, mais qui n'inclut pas la liaison de ligands métalliques
- Par exemple, orbitales
- ensemble de deux orbitales d orientées sur les axes cartésiens pour les complexes de coordination ; dans les complexes octaédriques, leur énergie est supérieure à celle des orbitales t 2 g
- isomères géométriques
- des isomères qui diffèrent dans la manière dont les atomes sont orientés les uns par rapport aux autres dans l'espace, ce qui entraîne des propriétés physiques et chimiques différentes
- complexe à spin élevé
- complexe dans lequel les électrons maximisent le spin total des électrons en peuplant individuellement toutes les orbitales avant d'apparier deux électrons sur les orbitales de faible énergie
- complexe à faible spin
- complexe dans lequel les électrons minimisent le spin total des électrons en s'appariant dans les orbitales de faible énergie avant de peupler les orbitales de plus haute énergie
- énergie d'appariement (P)
- énergie nécessaire pour placer deux électrons ayant des spins opposés sur une seule orbitale
- séries spectrochimiques
- classement des ligands en fonction de l'amplitude de la division du champ cristallin qu'ils induisent
- ligand à champ fort
- ligand qui provoque des divisions de champ cristallin plus importantes
- 2 à 2 kg d'orbitales
- ensemble de trois orbitales d alignées entre les axes cartésiens pour les complexes de coordination ; dans les complexes octaédriques, leur énergie est inférieure à celle des orbitales e g selon la CFT
- ligand à champ faible
- ligand qui provoque de petites divisions de champs cristallins


