19.1 : Propriétés des métaux de transition et de leurs composés
- Page ID
- 194002
- Décrire l'approche générale pour isoler les métaux de transition des sources naturelles
- Décrire les propriétés physiques et chimiques typiques des métaux de transition
- Nommer des classes de composés simples pour les métaux de transition et décrire leurs propriétés chimiques
Nous sommes quotidiennement en contact avec de nombreux métaux de transition. Le fer est présent partout : des anneaux de votre carnet à spirale aux couverts de votre cuisine, en passant par les automobiles, les navires, les bâtiments et l'hémoglobine présente dans votre sang. Le titane est utile dans la fabrication de produits légers et durables tels que des cadres de vélos, des hanches artificielles et des bijoux. Le chrome est utile comme revêtement protecteur sur les appareils de plomberie et les détails automobiles.
Les métaux de transition sont définis comme les éléments qui ont (ou forment facilement) des orbitales d partiellement remplies. Comme le montre la figure\(\PageIndex{2}\), les éléments du bloc d des groupes 3 à 11 sont des éléments de transition. Les éléments du bloc f, également appelés métaux de transition internes (les lanthanides et les actinides), répondent également à ce critère car l'orbitale d est partiellement occupée avant les orbitales f. Les orbitales d se remplissent de la famille du cuivre (groupe 11) ; pour cette raison, la famille suivante (groupe 12) ne sont techniquement pas des éléments de transition. Cependant, les éléments du groupe 12 présentent certaines des mêmes propriétés chimiques et sont généralement inclus dans les discussions sur les métaux de transition. Certains chimistes considèrent les éléments du groupe 12 comme des métaux de transition.

Les éléments du bloc d sont divisés en une première série de transitions (les éléments Sc à Cu), la deuxième série de transitions (les éléments Y à Ag) et la troisième série de transitions (l'élément La et les éléments Hf à Au). L'actinium, Ac, est le premier membre de la quatrième série de transition, qui comprend également Rf à Rg.
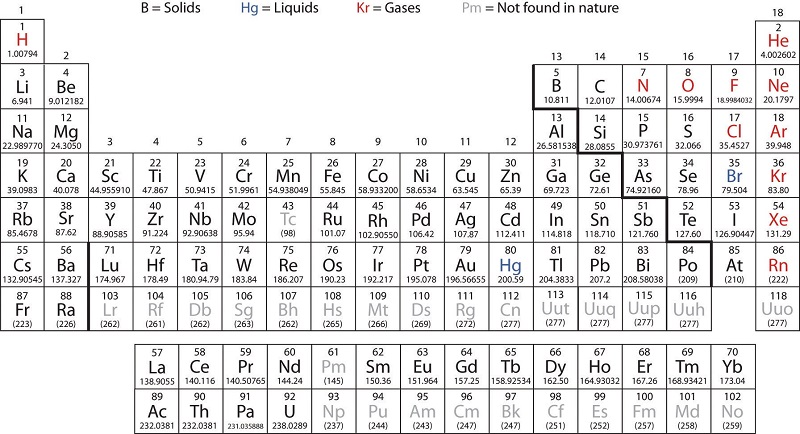
Les éléments du bloc f sont les éléments Ce à Lu, qui constituent la série des lanthanides (ou série des lanthanides), et les éléments Th à Lr, qui constituent la série des actinides (ou série des actinoïdes). Comme le lanthane se comporte très bien comme les éléments lanthanides, il est considéré comme un élément lanthanide, même si sa configuration électronique en fait le premier membre de la troisième série de transition. De même, le comportement de l'actinium signifie qu'il fait partie de la série des actinides, bien que sa configuration électronique en fasse le premier membre de la quatrième série de transition.
Découvrez comment écrire des configurations électroniques, abordée dans le chapitre sur la structure électronique et les propriétés périodiques des éléments. Rappelons que pour les métaux de transition et de transition internes, il est nécessaire de retirer les électrons s avant les électrons d ou f. Ensuite, pour chaque ion, donnez la configuration électronique :
- cérium (III)
- plomb (II)
- Astuce 2 +
- Suis 3 et plus
- Pd 2 +
Pour les exemples qui sont des métaux de transition, déterminez à quelle série ils appartiennent.
Solution
Pour les ions, les électrons de valence s sont perdus avant les électrons d ou f.
- Ce 3 + [Xe] 4 f 1 ; Ce 3 + est un élément de transition interne de la série des lanthanides.
- Pb 2 + [Xe] 6 s 2 5 d 10 4 f 14 ; les électrons sont perdus sur l'orbitale p. Il s'agit d'un élément principal du groupe.
- titane (II) [Ar] 3 d 2 ; première série de transition
- américium (III) [Rn] 5 f 6 ; actinide
- palladium (II) [Kr] 4 d 8 ; deuxième série de transition
Vérifiez votre apprentissage Donnez un exemple d'ion de la première série de transition sans électrons d.
- Réponse
-
V 5+ est une possibilité. D'autres exemples incluent Sc 3 +, Ti 4 +, Cr 6 + et Mn 7 +.
Les lanthanides (éléments 57 à 71) sont assez abondants dans la croûte terrestre, bien qu'ils aient été historiquement considérés comme des terres rares. Le thulium, le lanthanoïde naturel le plus rare, est plus commun dans la croûte terrestre que l'argent (4,5 × 10 −5 % contre 0,79 × 10 −5 % en masse). Il existe 17 éléments de terres rares, dont les 15 lanthanides, le scandium et l'yttrium. Ils sont qualifiés de rares parce qu'ils étaient autrefois difficiles à extraire de manière économique. Il était donc rare d'avoir un échantillon pur ; en raison de propriétés chimiques similaires, il est difficile de séparer un lanthanide des autres. Cependant, de nouvelles méthodes de séparation, telles que les résines échangeuses d'ions similaires à celles utilisées dans les adoucisseurs d'eau domestiques, facilitent la séparation de ces éléments et la rendent plus économique. La plupart des minerais qui contiennent ces éléments contiennent de faibles concentrations de tous les éléments des terres rares mélangés entre eux.
Les applications commerciales des lanthanides se développent rapidement. Par exemple, l'europium joue un rôle important dans les écrans plats que l'on trouve sur les écrans d'ordinateurs, les téléphones portables et les téléviseurs. Le néodyme est utile dans les disques durs des ordinateurs portables et dans les processus de conversion du pétrole brut en essence (Figure\(\PageIndex{3}\)). L'holmium se trouve dans les équipements dentaires et médicaux. En outre, de nombreuses technologies énergétiques alternatives reposent largement sur les lanthanides. Le néodyme et le dysprosium sont des composants clés des moteurs de véhicules hybrides et des aimants utilisés dans les éoliennes.

La demande de produits à base de lanthanides ayant augmenté plus rapidement que l'offre, les prix ont également augmenté. En 2008, le dysprosium coûtait 110 dollars le kg ; en 2014, le prix était passé à 470 dollars le kg. L'augmentation de l'offre d'éléments lanthanides est l'un des défis les plus importants auxquels sont confrontées les industries qui s'appuient sur les propriétés optiques et magnétiques de ces matériaux.
Les éléments de transition ont de nombreuses propriétés communes avec d'autres métaux. Ce sont presque tous des solides durs à point de fusion élevé qui conduisent bien la chaleur et l'électricité. Ils forment facilement des alliages et perdent des électrons pour former des cations stables. De plus, les métaux de transition forment une grande variété de composés de coordination stables, dans lesquels l'atome ou l'ion métallique central agit comme un acide de Lewis et accepte une ou plusieurs paires d'électrons. De nombreuses molécules et ions différents peuvent donner des paires isolées au centre métallique, servant de bases de Lewis. Dans ce chapitre, nous nous concentrerons principalement sur le comportement chimique des éléments de la première série de transition.
Propriétés des éléments de transition
Les métaux de transition présentent un large éventail de comportements chimiques. Comme le montre leur potentiel de réduction (Tableau P1), certains métaux de transition sont des agents réducteurs puissants, tandis que d'autres ont une très faible réactivité. Par exemple, les lanthanides forment tous des cations aqueux 3+ stables. La force motrice de ces oxydations est similaire à celle des métaux alcalino-terreux tels que Be ou Mg, formant du Be 2 + et du Mg 2 +. D'autre part, des matériaux tels que le platine et l'or ont des potentiels de réduction beaucoup plus élevés. Leur capacité à résister à l'oxydation en fait des matériaux utiles pour la construction de circuits et de bijoux.
Les ions des éléments à bloc d plus légers, tels que le Cr 3 +, le Fe 3 + et le Co 2 +, forment des ions hydratés colorés qui sont stables dans l'eau. Cependant, les ions se trouvant juste en dessous de ces périodes (Mo 3 +, Ru 3 + et Ir 2 +) sont instables et réagissent facilement avec l'oxygène de l'air. La majorité des ions simples et stables dans l'eau formés par les éléments plus lourds du bloc d sont des oxyanions tels que\(\ce{MoO4^2-}\) et\(\ce{ReO4-}\).
Le ruthénium, l'osmium, le rhodium, l'iridium, le palladium et le platine sont les métaux du platine. Ils forment difficilement des cations simples qui sont stables dans l'eau et, contrairement aux éléments antérieurs des deuxième et troisième séries de transition, ils ne forment pas d'oxyanions stables.
Les éléments des blocs d et f réagissent tous deux avec des éléments non métalliques pour former des composés binaires ; un chauffage est souvent nécessaire. Ces éléments réagissent avec les halogènes pour former une variété d'halogénures dont l'état d'oxydation varie de 1+ à 6+. Lors du chauffage, l'oxygène réagit avec tous les éléments de transition à l'exception du palladium, du platine, de l'argent et de l'or. Les oxydes de ces derniers métaux peuvent être formés à l'aide d'autres réactifs, mais ils se décomposent par chauffage. Les éléments du bloc f, les éléments du groupe 3 et les éléments de la première série de transition, à l'exception du cuivre, réagissent avec des solutions aqueuses d'acides, formant de l'hydrogène gazeux et des solutions des sels correspondants.
Les métaux de transition peuvent former des composés présentant un large éventail d'états d'oxydation. Certains des états d'oxydation observés des éléments de la première série de transition sont présentés sur la figure\(\PageIndex{4}\). Au fur et à mesure que nous nous déplaçons de gauche à droite dans la première série de transitions, nous constatons que le nombre d'états d'oxydation courants augmente d'abord jusqu'à un maximum vers le milieu du tableau, puis diminue. Les valeurs du tableau sont des valeurs typiques ; il existe d'autres valeurs connues et il est possible de synthétiser de nouveaux ajouts. Par exemple, en 2014, des chercheurs ont réussi à synthétiser un nouvel état d'oxydation de l'iridium (9+).
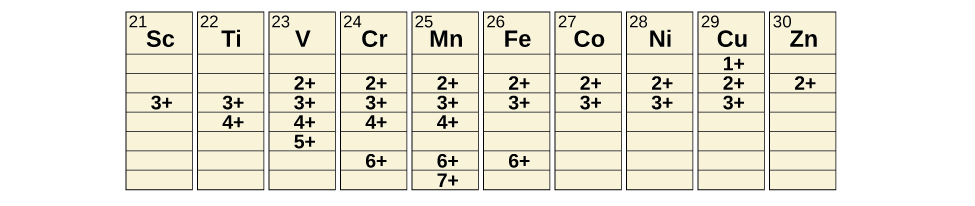
Pour les éléments du scandium au manganèse (la première moitié de la première série de transition), l'état d'oxydation le plus élevé correspond à la perte de tous les électrons sur les orbitales s et d de leurs couches de valence. L'ion titane (IV), par exemple, se forme lorsque l'atome de titane perd ses deux électrons 3d et ses deux électrons 4s. Ces états d'oxydation les plus élevés sont les formes les plus stables de scandium, de titane et de vanadium. Cependant, il n'est pas possible de continuer à éliminer tous les électrons de valence des métaux au fur et à mesure que nous poursuivons la série. Le fer est connu pour former des états d'oxydation de 2+ à 6+, le fer (II) et le fer (III) étant les plus courants. La plupart des éléments de la première série de transition forment des ions d'une charge de 2+ ou 3+ qui sont stables dans l'eau, bien que ceux des premiers membres de la série puissent être facilement oxydés par l'air.
Les éléments des deuxième et troisième séries de transition sont généralement plus stables à des états d'oxydation élevés que les éléments de la première série. En général, le rayon atomique augmente vers le bas d'un groupe, ce qui conduit à ce que les ions des deuxième et troisième séries soient plus grands que ceux de la première série. Il est plus facile de retirer les électrons des orbites situées plus loin du noyau que d'éliminer les électrons situés à proximité du noyau. Par exemple, le molybdène et le tungstène, membres du groupe 6, se limitent principalement à un état d'oxydation de 6+ en solution aqueuse. Le chrome, le membre le plus léger du groupe, forme des ions Cr 3 + stables dans l'eau et, en l'absence d'air, des ions Cr 2 + moins stables. Le sulfure présentant l'état d'oxydation le plus élevé pour le chrome est le Cr 2 S 3, qui contient l'ion Cr 3 +. Le molybdène et le tungstène forment des sulfures dans lesquels les métaux présentent des états d'oxydation de 4+ et 6+.
Quel est l'agent oxydant le plus puissant en solution acide : l'ion dichromate, qui contient du chrome (VI), l'ion permanganate, qui contient du manganèse (VII), ou le dioxyde de titane, qui contient du titane (IV) ?
Solution
Tout d'abord, nous devons rechercher les demi-réactions de réduction (Tableau P1) pour chaque oxyde dans l'état d'oxydation spécifié :
\[\ce{Cr2O7^2- + 14H+ + 6e- ⟶ 2Cr^3+ + 7H2O} \hspace{20px} \mathrm{+1.33\: V} \nonumber \]
\[\ce{MnO4- + 8H+ + 5e- ⟶ Mn^2+ + H2O} \hspace{20px} \mathrm{+1.51\: V} \nonumber \]
\[\ce{TiO2 + 4H+ + 2e- ⟶ Ti^2+ + 2H2O} \hspace{20px} \mathrm{−0.50\: V} \nonumber \]
Un potentiel de réduction plus élevé signifie qu'il est plus facile de réduire le réactif. Le permanganate, qui présente le plus grand potentiel de réduction, est l'oxydant le plus puissant dans ces conditions. Le dichromate vient ensuite, suivi du dioxyde de titane en tant qu'agent oxydant le plus faible (le plus difficile à réduire) de cet ensemble.
Prédisez quelle réaction (le cas échéant) se produira entre HCl et Co (s), et entre HBr et Pt (s). Vous devrez utiliser les potentiels de réduction standard de (Tableau P1).
- Réponse
-
\(\ce{Co}(s)+\ce{2HCl}⟶\ce{H2}+\ce{CoCl2}(aq)\); aucune réaction car le Pt (s) ne sera pas oxydé par H +
Préparation des éléments de transition
Les anciennes civilisations connaissaient le fer, le cuivre, l'argent et l'or. Les périodes de l'histoire de l'humanité appelées âge du bronze et âge du fer marquent les progrès au cours desquels les sociétés ont appris à isoler certains métaux et à les utiliser pour fabriquer des outils et des biens. Les minerais naturels de cuivre, d'argent et d'or peuvent contenir de fortes concentrations de ces métaux sous forme élémentaire (Figure\(\PageIndex{5}\)). Le fer, quant à lui, est présent sur terre presque exclusivement sous des formes oxydées, telles que la rouille (Fe 2 O 3). Les premiers outils en fer connus étaient fabriqués à partir de météorites de fer. Les artefacts en fer survivants datant d'environ 4000 à 2500 av. J.-C. sont rares, mais tous les exemples connus contiennent des alliages spécifiques de fer et de nickel qui ne se trouvent que dans des objets extraterrestres, et non sur Terre. Il a fallu des milliers d'années de progrès technologiques avant que les civilisations ne développent la fusion du fer, la capacité d'extraire un élément pur de ses minerais naturels et que les outils en fer deviennent courants.

Généralement, les éléments de transition sont extraits de minéraux présents dans divers minerais. Cependant, leur facilité de récupération varie considérablement, en fonction de la concentration de l'élément dans le minerai, de l'identité des autres éléments présents et de la difficulté de réduire l'élément en métal libre.
En général, il n'est pas difficile de réduire les ions des éléments du bloc d en éléments libres. Le carbone est un agent réducteur suffisamment puissant dans la plupart des cas. Cependant, comme les ions des métaux du groupe principal les plus actifs, les ions des éléments du bloc f doivent être isolés par électrolyse ou par réduction avec un métal actif tel que le calcium.
Nous discuterons des procédés utilisés pour isoler le fer, le cuivre et l'argent, car ces trois procédés illustrent les principaux moyens d'isoler la plupart des métaux du bloc d. En général, chacun de ces procédés comporte trois étapes principales : le traitement préliminaire, la fusion et le raffinage.
- Traitement préliminaire. En général, il y a un traitement initial des minerais pour les rendre aptes à l'extraction des métaux. Cela implique généralement le concassage ou le broyage du minerai, la concentration des composants contenant du métal et parfois le traitement chimique de ces substances pour les convertir en composés plus faciles à réduire en métal.
- Fusion. L'étape suivante est l'extraction du métal à l'état fondu, un processus appelé fusion, qui comprend la réduction du composé métallique en métal. Les impuretés peuvent être éliminées par l'ajout d'un composé qui forme des scories, une substance ayant un point de fusion bas qui peut être facilement séparée du métal fondu.
- Raffinage. La dernière étape de la récupération d'un métal consiste à le raffiner. Les métaux à bas point d'ébullition tels que le zinc et le mercure peuvent être raffinés par distillation. Lorsqu'ils sont fondus sur une table inclinée, les métaux à bas point de fusion, tels que l'étain, s'écoulent loin des impuretés L'électrolyse est une autre méthode courante d'affinage des métaux.
Isolation du fer
L'application précoce du fer à la fabrication d'outils et d'armes a été possible grâce à la large distribution des minerais de fer et à la facilité avec laquelle les composés de fer contenus dans les minerais pouvaient être réduits par le carbone. Pendant longtemps, le charbon de bois a été la forme de carbone utilisée dans le processus de réduction. La production et l'utilisation du fer se sont beaucoup plus répandues vers 1620, lorsque le coke a été introduit comme agent réducteur. Le coke est une forme de carbone formée en chauffant du charbon en l'absence d'air pour éliminer les impuretés.
La première étape de la métallurgie du fer consiste généralement à griller le minerai (le chauffer à l'air) pour en retirer l'eau, à décomposer les carbonates en oxydes et à convertir les sulfures en oxydes. Les oxydes sont ensuite réduits dans un haut fourneau de 80 à 100 pieds de haut et d'environ 25 pieds de diamètre (Figure\(\PageIndex{6}\)) dans lequel le minerai torréfié, le coke et le calcaire (CaCO 3 impur) sont introduits en continu par le haut. Le fer fondu et les scories sont retirés par le bas. La totalité du stock d'un four peut peser plusieurs centaines de tonnes.

Près du bas d'un four se trouvent des buses à travers lesquelles de l'air préchauffé est soufflé dans le four. Dès que l'air entre, le coke se trouvant au niveau des buses est oxydé en dioxyde de carbone avec dégagement d'une grande quantité de chaleur. Le dioxyde de carbone chaud passe vers le haut à travers la couche supérieure de coke chauffé à la chaux, où il est réduit en monoxyde de carbone :
\[\ce{CO2}(g)+\ce{C}(s)⟶\ce{2CO}(g) \nonumber \]
Le monoxyde de carbone sert d'agent réducteur dans les zones supérieures du four. Les réactions individuelles sont indiquées sur la figure\(\PageIndex{6}\).
Les oxydes de fer sont réduits dans la partie supérieure du four. Dans la région centrale, le calcaire (carbonate de calcium) se décompose et l'oxyde de calcium qui en résulte se combine à la silice et aux silicates contenus dans le minerai pour former des scories. Les scories sont principalement constituées de silicate de calcium et contiennent la plupart des composants du minerai qui n'ont pas d'importance commerciale :
\[\ce{CaO}(s)+\ce{SiO2}(s)⟶\ce{CaSiO3}(l) \nonumber \]
Juste en dessous du milieu du four, la température est suffisamment élevée pour faire fondre à la fois le fer et les scories. Ils s'accumulent en couches au fond du four ; les scories les moins denses flottent sur le fer et le protègent de l'oxydation. Plusieurs fois par jour, les scories et le fer fondu sont retirés du four. Le fer est transféré vers des machines de coulée ou vers une usine sidérurgique (Figure\(\PageIndex{7}\)).

Une grande partie du fer produit est raffinée et transformée en acier. L'acier est fabriqué à partir de fer en éliminant les impuretés et en ajoutant des substances telles que le manganèse, le chrome, le nickel, le tungstène, le molybdène et le vanadium pour produire des alliages dont les propriétés rendent le matériau adapté à des utilisations spécifiques. La plupart des aciers contiennent également des pourcentages faibles mais définis de carbone (0,04 % à 2,5 %). Cependant, une grande partie du carbone contenu dans le fer doit être éliminée lors de la fabrication de l'acier ; sinon, l'excès de carbone fragiliserait le fer.
Isolation du cuivre
Les minerais de cuivre les plus importants contiennent des sulfures de cuivre (tels que la covellite, les CuS), bien que l'on trouve parfois des oxydes de cuivre (tels que la ténorite, le CuO) et des hydroxycarbonates de cuivre [tels que la malachite, le Cu 2 (OH) 2 CO 3]. Lors de la production de cuivre métallique, le minerai de sulfure concentré est torréfié pour éliminer une partie du soufre sous forme de dioxyde de soufre. Le mélange restant, composé de Cu 2 S, FeS, FeO et SiO 2, est mélangé à du calcaire, qui sert de fondant (un matériau qui aide à éliminer les impuretés), et chauffé. Des scories fondues se forment lorsque le fer et la silice sont éliminés par des réactions acide-base de Lewis :
\[\ce{CaCO3}(s)+\ce{SiO2}(s)⟶\ce{CaSiO3}(l)+\ce{CO2}(g) \nonumber \]
\[\ce{FeO}(s)+\ce{SiO2}(s)⟶\ce{FeSiO3}(l) \nonumber \]
Dans ces réactions, le dioxyde de silicium se comporte comme un acide de Lewis, qui accepte une paire d'électrons de la base de Lewis (l'ion oxyde).
La réduction du Cu 2 S restant après la fusion est réalisée en soufflant de l'air à travers le matériau fondu. L'air convertit une partie du Cu 2 S en Cu 2 O. Dès que l'oxyde de cuivre (I) se forme, il est réduit par le sulfure de cuivre (I) restant en cuivre métallique :
\[\ce{2Cu2S}(l)+\ce{3O2}(g)⟶\ce{2Cu2O}(l)+\ce{2SO2}(g) \nonumber \]
\[\ce{2Cu2O}(l)+\ce{Cu2S}(l)⟶\ce{6Cu}(l)+\ce{SO2}(g) \nonumber \]
Le cuivre ainsi obtenu est appelé cuivre blister en raison de son aspect caractéristique, dû aux cloques d'air qu'il contient (Figure\(\PageIndex{8}\)). Ce cuivre impur est coulé dans de grandes plaques, qui sont utilisées comme anodes dans le raffinage électrolytique du métal (décrit dans le chapitre sur l'électrochimie).

Isolation d'argent
L'argent se trouve parfois dans de grosses pépites (Figure\(\PageIndex{9}\)) mais plus fréquemment dans les veines et les dépôts connexes. À une certaine époque, le panoramique était une méthode efficace pour isoler les pépites d'argent et d'or. En raison de leur faible réactivité, ces métaux et quelques autres sont présents dans les dépôts sous forme de pépites. La découverte du platine est due au fait que les explorateurs espagnols d'Amérique centrale ont confondu des pépites de platine avec de l'argent. Lorsque le métal ne se présente pas sous forme de pépites, il est souvent utile d'utiliser un procédé appelé hydrométallurgie pour séparer l'argent de ses minerais.

L'hydrologie consiste à séparer un métal d'un mélange en le convertissant d'abord en ions solubles, puis en les extrayant et en les réduisant pour précipiter le métal pur. En présence d'air, les cyanures de métaux alcalins forment facilement l'ion dicyanoargentate (I) soluble\(\ce{[Ag(CN)2]-}\), à partir de métal argenté ou de composés contenant de l'argent tels que l'Ag 2 S et l'AgCl. Les équations représentatives sont :
\[\ce{4Ag}(s)+\ce{8CN-}(aq)+\ce{O2}(g)+\ce{2H2O}(l)⟶\ce{4[Ag(CN)2]-}(aq)+\ce{4OH-}(aq) \nonumber \]
\[\ce{2Ag2S}(s)+\ce{8CN-}(aq)+\ce{O2}(g)+\ce{2H2O}(l)⟶\ce{4[Ag(CN)2]-}(aq)+\ce{2S}(s)+\ce{4OH-}(aq) \nonumber \]
\[\ce{AgCl}(s)+\ce{2CN-}(aq)⟶\ce{[Ag(CN)2]-}(aq)+\ce{Cl-}(aq) \nonumber \]
L'argent est précipité à partir de la solution de cyanure par addition d'ions zinc ou fer (II), qui servent d'agent réducteur :
\[\ce{2[Ag(CN)2]-}(aq)+\ce{Zn}(s)⟶\ce{2Ag}(s)+\ce{[Zn(CN)4]^2-}(aq) \nonumber \]
L'une des étapes du raffinage de l'argent consiste à convertir l'argent en ions dicyanoargénate (I) :
\[\ce{4Ag}(s)+\ce{8CN-}(aq)+\ce{O2}(g)+\ce{2H2O}(l)⟶\ce{4[Ag(CN)2]-}(aq)+\ce{4OH-}(aq) \nonumber \]
Expliquez pourquoi de l'oxygène doit être présent pour effectuer la réaction. Pourquoi la réaction ne se produit-elle pas comme suit :
\[\ce{4Ag}(s)+\ce{8CN-}(aq)⟶\ce{4[Ag(CN)2]-}(aq)? \nonumber \]
Solution de soja
Les charges, tout comme les atomes, doivent s'équilibrer lors des réactions. L'atome d'argent est oxydé de l'état d'oxydation 0 à l'état 1+. Chaque fois que quelque chose perd des électrons, quelque chose doit également gagner des électrons (être réduit) pour équilibrer l'équation. L'oxygène est un bon agent oxydant pour ces réactions car il peut gagner des électrons pour passer de l'état d'oxydation 0 à l'état 2−.
Lors du raffinage du fer, du carbone doit être présent dans le haut fourneau. Pourquoi le carbone est-il nécessaire pour convertir l'oxyde de fer en fer ?
- Réponse
-
Le carbone est converti en CO, qui est l'agent réducteur qui accepte les électrons afin que le fer (III) puisse être réduit en fer (0).
composés de métaux de transition
La liaison dans les composés simples des éléments de transition varie de ionique à covalente. Dans leurs états d'oxydation inférieurs, les éléments de transition forment des composés ioniques ; dans leurs états d'oxydation supérieurs, ils forment des composés covalents ou des ions polyatomiques. La variation des états d'oxydation présentés par les éléments de transition confère à ces composés une chimie d'oxydoréduction à base de métaux. La chimie de plusieurs classes de composés contenant des éléments de la série de transition suit.
Halogénures
Les halogénures anhydres de chacun des éléments de transition peuvent être préparés par réaction directe du métal avec des halogènes. Par exemple :
\[\ce{2Fe}(s)+\ce{3Cl2}(g)⟶\ce{2FeCl3}(s) \nonumber \]
Le chauffage d'un halogénure métallique avec du métal supplémentaire peut être utilisé pour former un halogénure du métal ayant un état d'oxydation inférieur :
\[\ce{Fe}(s)+\ce{2FeCl3}(s)⟶\ce{3FeCl2}(s) \nonumber \]
La stœchiométrie de l'halogénure métallique résultant de la réaction du métal avec un halogène est déterminée par les quantités relatives de métal et d'halogène et par la force de l'halogène en tant qu'agent oxydant. En général, le fluor forme des métaux contenant du fluorure dans leurs états d'oxydation les plus élevés. Les autres halogènes peuvent ne pas former de composés analogues.
En général, la préparation de solutions aqueuses stables des halogénures des métaux de la première série de transition consiste à ajouter un acide halogénhydrique à des carbonates, des hydroxydes, des oxydes ou d'autres composés contenant des anions basiques. Les réactions des échantillons sont :
\[\ce{NiCO3}(s)+\ce{2HF}(aq)⟶\ce{NiF2}(aq)+\ce{H2O}(l)+\ce{CO2}(g) \nonumber \]
\[\ce{Co(OH)2}(s)+\ce{2HBr}(aq)⟶\ce{CoBr2}(aq)+\ce{2H2O}(l) \nonumber \]
La plupart des métaux de la première série de transition se dissolvent également dans les acides, formant une solution de sel et d'hydrogène gazeux. Par exemple :
\[\ce{Cr}(s)+\ce{2HCl}(aq)⟶\ce{CrCl2}(aq)+\ce{H2}(g) \nonumber \]
La polarité des liaisons avec les métaux de transition varie en fonction non seulement de l'électronégativité des atomes concernés, mais également de l'état d'oxydation du métal de transition. N'oubliez pas que la polarité des liaisons est un spectre continu dans lequel les électrons sont répartis de manière égale (liaisons covalentes) à un extrême et les électrons entièrement transférés (liaisons ioniques) à l'autre. Aucune liaison n'est jamais ionique à 100 %, et le degré de répartition uniforme des électrons détermine de nombreuses propriétés du composé. Les halogénures de métaux de transition à faible indice d'oxydation forment davantage de liaisons ioniques. Par exemple, le chlorure de titane (II) et le chlorure de titane (III) (TiCl 2 et TiCl 3) ont des points de fusion élevés qui sont caractéristiques des composés ioniques, mais le chlorure de titane (IV) (TiCl 4) est un liquide volatil, ce qui indique qu'il possède des liaisons covalentes titane-chlore. Tous les halogénures des éléments plus lourds du bloc d présentent des caractéristiques covalentes significatives.
Le comportement covalent des métaux de transition présentant des états d'oxydation plus élevés est illustré par la réaction des tétrahalogénures métalliques avec l'eau. Comme le tétrachlorure de silicium covalent, les tétrahalogénures de titane et de vanadium réagissent avec l'eau pour donner des solutions contenant les acides halogénés correspondants et les oxydes métalliques :
\[\ce{SiCl4}(l)+\ce{2H2O}(l)⟶\ce{SiO2}(s)+\ce{4HCl}(aq) \nonumber \]
\[\ce{TiCl4}(l)+\ce{2H2O}(l)⟶\ce{TiO2}(s)+\ce{4HCl}(aq) \nonumber \]
oxydes
Comme pour les halogénures, la nature de la liaison dans les oxydes des éléments de transition est déterminée par l'état d'oxydation du métal. Les oxydes ayant de faibles états d'oxydation ont tendance à être plus ioniques, tandis que ceux qui présentent des états d'oxydation plus élevés sont plus covalents. Ces variations de collage sont dues au fait que les électronégativités des éléments ne sont pas des valeurs fixes. L'électronégativité d'un élément augmente avec l'augmentation de l'état d'oxydation. Les métaux de transition à faible état d'oxydation ont des valeurs d'électronégativité inférieures à celles de l'oxygène ; par conséquent, ces oxydes métalliques sont ioniques. Les métaux de transition à des états d'oxydation très élevés ont des valeurs d'électronégativité proches de celles de l'oxygène, ce qui conduit à la covalence de ces oxydes.
Les oxydes de la première série de transition peuvent être préparés en chauffant les métaux dans l'air. Ces oxydes sont le Sc 2 O 3, le TiO 2, le V 2 O 5, le Cr 2 O 3, le Mn 3 O 4, le Fe 3 O 4, le Co 3 O 4, le NiO et le CuO.
Ces oxydes et d'autres oxydes (les métaux se trouvant dans différents états d'oxydation) peuvent également être produits en chauffant les hydroxydes, carbonates ou oxalates correspondants dans une atmosphère inerte. L'oxyde de fer (II) peut être préparé en chauffant de l'oxalate de fer (II), et l'oxyde de cobalt (II) est produit en chauffant de l'hydroxyde de cobalt (II) :
\[\ce{FeC2O4}(s)⟶\ce{FeO}(s)+\ce{CO}(g)+\ce{CO2}(g) \nonumber \]
\[\ce{Co(OH)2}(s)⟶\ce{CoO}(s)+\ce{H2O}(g) \nonumber \]
À l'exception du CrO 3 et du Mn 2 O 7, les oxydes de métaux de transition ne sont pas solubles dans l'eau. Ils peuvent réagir avec les acides et, dans certains cas, avec les bases. Dans l'ensemble, les oxydes des métaux de transition présentant les états d'oxydation les plus faibles sont basiques (et réagissent avec les acides), les oxydes intermédiaires sont amphotères et les états d'oxydation les plus élevés sont principalement acides. Les oxydes métalliques basiques à faible état d'oxydation réagissent avec les acides aqueux pour former des solutions de sels et d'eau. Les exemples incluent la réaction entre l'oxyde de cobalt (II) acceptant les protons de l'acide nitrique et l'oxyde de scandium (III) acceptant les protons de l'acide chlorhydrique :
\[\ce{CoO}(s)+\ce{2HNO3}(aq)⟶\ce{Co(NO3)2}(aq)+\ce{H2O}(l) \nonumber \]
\[\ce{Sc2O3}(s)+\ce{6HCl}(aq)⟶\ce{2ScCl3}(aq)+\ce{3H2O}(l) \nonumber \]
Les oxydes de métaux dont l'état d'oxydation est 4+ sont amphotères et la plupart ne sont solubles ni dans les acides ni dans les bases. L'oxyde de vanadium (V), l'oxyde de chrome (VI) et l'oxyde de manganèse (VII) sont acides. Ils réagissent avec des solutions d'hydroxydes pour former des sels des oxyanions\(\ce{VO4^3-}\)\(\ce{CrO4^2-}\), et\(\ce{MnO4-}\). Par exemple, l'équation ionique complète pour la réaction de l'oxyde de chrome (VI) avec une base forte est donnée par :
\[\ce{CrO3}(s)+\ce{2Na+}(aq)+\ce{2OH-}(aq)⟶\ce{2Na+}(aq)+\ce{CrO4^2-}(aq)+\ce{H2O}(l) \nonumber \]
L'oxyde de chrome (VI) et l'oxyde de manganèse (VII) réagissent avec l'eau pour former les acides H 2 CrO 4 et HmNO 4, respectivement.
Hydroxydes
Lorsqu'un hydroxyde soluble est ajouté à une solution aqueuse d'un sel d'un métal de transition de la première série de transition, un précipité gélatineux se forme. Par exemple, l'ajout d'une solution d'hydroxyde de sodium à une solution de sulfate de cobalt produit un précipité gélatineux rose ou bleu d'hydroxyde de cobalt (II). L'équation ionique nette est la suivante :
\[\ce{Co^2+}(aq)+\ce{2OH-}(aq)⟶\ce{Co(OH)2}(s) \nonumber \]
Dans ce cas et dans bien d'autres, ces précipités sont des hydroxydes contenant l'ion du métal de transition, des ions hydroxyde et de l'eau coordonnés au métal de transition. Dans les autres cas, les précipités sont des oxydes hydratés composés de l'ion métallique, des ions oxydes et de l'eau d'hydratation :
\[\ce{4Fe^3+}(aq)+\ce{6OH-}(aq)+\ce{nH2O}(l)⟶\ce{2Fe2O3⋅(n + 3)H2O}(s) \nonumber \]
Ces substances ne contiennent pas d'ions hydroxyde. Cependant, les hydroxydes et les oxydes hydratés réagissent avec les acides pour former des sels et de l'eau. Lors de la précipitation d'un métal à partir d'une solution, il est nécessaire d'éviter tout excès d'ions hydroxyde, car cela pourrait entraîner la formation d'ions complexes, comme indiqué plus loin dans ce chapitre. Les hydroxydes métalliques précipités peuvent être séparés pour un traitement ultérieur ou pour l'élimination des déchets.
Carbonates
De nombreux éléments de la première série de transition forment des carbonates insolubles. Il est possible de préparer ces carbonates en ajoutant un sel de carbonate soluble à une solution d'un sel de métal de transition. Par exemple, le carbonate de nickel peut être préparé à partir de solutions de nitrate de nickel et de carbonate de sodium selon l'équation ionique nette suivante :
\[\ce{Ni^2+}(aq)+\ce{CO3^2-}⟶\ce{NiCO3}(s) \nonumber \]
Les réactions des carbonates de métaux de transition sont similaires à celles des carbonates de métaux actifs. Ils réagissent avec les acides pour former des sels métalliques, du dioxyde de carbone et de l'eau. Lorsqu'ils sont chauffés, ils se décomposent et forment les oxydes de métaux de transition.
Autres sels
À bien des égards, le comportement chimique des éléments de la première série de transition est très similaire à celui des métaux du groupe principal. En particulier, les mêmes types de réactions que ceux utilisés pour préparer les sels des métaux du groupe principal peuvent être utilisés pour préparer des sels ioniques simples de ces éléments.
Divers sels peuvent être préparés à partir de métaux plus actifs que l'hydrogène par réaction avec les acides correspondants : le scandium métallique réagit avec l'acide bromhydrique pour former une solution de bromure de scandium :
\[\ce{2Sc}(s)+\ce{6HBr}(aq)⟶\ce{2ScBr3}(aq)+\ce{3H2}(g) \nonumber \]
Les composés courants dont nous venons de parler peuvent également être utilisés pour préparer des sels. Les réactions impliquées incluent les réactions d'oxydes, d'hydroxydes ou de carbonates avec des acides. Par exemple :
\[\ce{Ni(OH)2}(s)+\ce{2H3O+}(aq)+\ce{2ClO4-}(aq)⟶\ce{Ni^2+}(aq)+\ce{2ClO4-}(aq)+\ce{4H2O}(l) \nonumber \]
Des réactions de substitution impliquant des sels solubles peuvent être utilisées pour préparer des sels insolubles. Par exemple :
\[\ce{Ba^2+}(aq)+\ce{2Cl-}(aq)+\ce{2K+}(aq)+\ce{CrO4^2-}(aq)⟶\ce{BaCrO4}(s)+\ce{2K+}(aq)+\ce{2Cl-}(aq) \nonumber \]
Dans notre discussion des oxydes dans cette section, nous avons vu que les réactions des oxydes covalents des éléments de transition avec les hydroxydes forment des sels contenant des oxyanions des éléments de transition.
Supraconducteurs haute température
Un supraconducteur est une substance qui conduit l'électricité sans résistance. Ce manque de résistance signifie qu'il n'y a pas de perte d'énergie lors de la transmission de l'électricité. Cela conduirait à une réduction significative du coût de l'électricité.
Les matériaux supraconducteurs commerciaux les plus couramment utilisés, tels que le NBTi et le Nb 3 Sn, ne deviennent supraconducteurs que lorsqu'ils sont refroidis en dessous de 23 K (−250 °C). Cela nécessite l'utilisation d'hélium liquide, qui a une température d'ébullition de 4 K, est coûteux et difficile à manipuler. Le coût de l'hélium liquide a découragé l'utilisation généralisée des supraconducteurs.
L'une des découvertes scientifiques les plus intéressantes des années 1980 a été la caractérisation de composés qui présentent une supraconductivité à des températures supérieures à 90 K. (Par rapport à l'hélium liquide, 90 K est une température élevée.) Parmi les matériaux supraconducteurs à haute température, on trouve généralement les oxydes contenant de l'yttrium (ou l'un des nombreux éléments des terres rares), du baryum et du cuivre dans un rapport de 1:2:3. La formule du composé d'yttrium ionique est YbA 2 Cu 3 O 7.
Les nouveaux matériaux deviennent supraconducteurs à des températures proches de 90 K (Figure\(\PageIndex{10}\)), températures qui peuvent être atteintes par refroidissement à l'azote liquide (température d'ébullition de 77 K). Non seulement les matériaux refroidis à l'azote liquide sont plus faciles à manipuler, mais les coûts de refroidissement sont également environ 1000 fois inférieurs à ceux de l'hélium liquide.
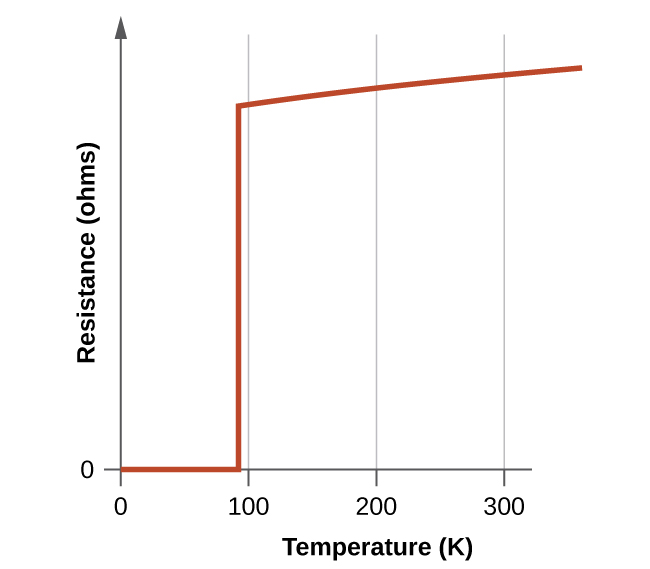
Bien que la nature fragile et fragile de ces matériaux entrave actuellement leurs applications commerciales, ils présentent un énorme potentiel que les chercheurs travaillent d'arrache-pied pour améliorer leurs procédés afin de les aider à réaliser. Les lignes de transmission supraconductrices transporteraient le courant sur des centaines de kilomètres sans perte de puissance due à la résistance des fils. Cela pourrait permettre de placer des centrales dans des zones éloignées des centres de population et à proximité des ressources naturelles nécessaires à la production d'électricité. Le premier projet démontrant la viabilité de la transmission d'énergie par des supraconducteurs à haute température a été lancé à New York en 2008.

Les chercheurs s'efforcent également d'utiliser cette technologie pour développer d'autres applications, telles que des micropuces plus petites et plus puissantes. En outre, les supraconducteurs à haute température peuvent être utilisés pour générer des champs magnétiques destinés à des applications telles que des dispositifs médicaux, des trains à lévitation magnétique et des champs de confinement pour les réacteurs de fusion nucléaire (Figure\(\PageIndex{11}\)).
Résumé
Les métaux de transition sont des éléments dont les orbitales d sont partiellement remplies, situés dans le bloc d du tableau périodique. La réactivité des éléments de transition varie largement, allant de métaux très actifs tels que le scandium et le fer à des éléments presque inertes, tels que les métaux du platine. Le type de chimie utilisé pour isoler les éléments de leurs minerais dépend de la concentration de l'élément dans le minerai et de la difficulté de réduire les ions des éléments en métaux. Les métaux les plus actifs sont plus difficiles à réduire.
Les métaux de transition présentent un comportement chimique typique des métaux. Par exemple, ils s'oxydent dans l'air lorsqu'ils sont chauffés et réagissent avec les halogènes élémentaires pour former des halogénures. Les éléments situés au-dessus de l'hydrogène dans la série d'activités réagissent avec les acides, produisant des sels et de l'hydrogène gazeux. Les oxydes, hydroxydes et carbonates des composés de métaux de transition à faible état d'oxydation sont basiques. Les halogénures et autres sels sont généralement stables dans l'eau, bien que l'oxygène doive être exclu dans certains cas. La plupart des métaux de transition présentent divers états d'oxydation stables, ce qui leur permet de démontrer une large gamme de réactivité chimique.
Lexique
- série actinide
- (également, série d'actinoïdes) l'actinium et les éléments de la deuxième rangée ou du bloc f, numéros atomiques 89—103
- composé de coordination
- composé stable dans lequel l'atome ou l'ion métallique central agit comme un acide de Lewis et accepte une ou plusieurs paires d'électrons
- élément d -block
- l'un des éléments des groupes 3 à 11 avec des électrons de valence sur les orbitales d
- élément f -block
- (également, élément de transition interne) l'un des éléments de numéros atomiques 58—71 ou 90-103 qui ont des électrons de valence sur des orbitales f ; ils sont fréquemment représentés décalés en dessous du tableau périodique
- première série de transition
- éléments de transition de la quatrième période du tableau périodique (première ligne du bloc d), numéros atomiques 21 à 29
- quatrième série de transition
- éléments de transition de la septième période du tableau périodique (quatrième ligne du bloc d), numéros atomiques 89 et 104 à 111
- hydrométallurgie
- procédé dans lequel un métal est séparé d'un mélange en le convertissant d'abord en ions solubles, en extrayant les ions, puis en réduisant les ions pour précipiter le métal pur
- série de lanthanides
- (également, série des lanthanides) le lanthane et les éléments de la première rangée ou du bloc f, numéros atomiques 57—71
- métaux en platine
- groupe de six métaux de transition comprenant le ruthénium, l'osmium, le rhodium, l'iridium, le palladium et le platine qui ont tendance à se trouver dans les mêmes minéraux et présentent des propriétés chimiques similaires
- élément de terre rare
- collection de 17 éléments, y compris les lanthanides, le scandium et l'yttrium, qui se trouvent souvent ensemble et ont des propriétés chimiques similaires, ce qui rend la séparation difficile
- deuxième série de transition
- éléments de transition de la cinquième période du tableau périodique (deuxième ligne du bloc d), numéros atomiques 39—47
- fonte
- procédé d'extraction d'un métal pur à partir d'un minerai fondu
- acier
- matériau fabriqué à partir de fer en éliminant les impuretés présentes dans le fer et en ajoutant des substances qui produisent des alliages aux propriétés adaptées à des utilisations spécifiques
- supraconducteur
- matériau qui conduit l'électricité sans résistance
- troisième série de transition
- éléments de transition de la sixième période du tableau périodique (troisième ligne du bloc d), numéros atomiques 57 et 72-79


