8.2 : Orbitales atomiques hybrides
- Page ID
- 193898
- Expliquer le concept d'hybridation orbitale atomique
- Déterminer les orbitales hybrides associées à différentes géométries moléculaires
Penser en termes de superposition d'orbitales atomiques est une façon pour nous d'expliquer comment les liaisons chimiques se forment dans les molécules diatomiques. Cependant, pour comprendre comment les molécules de plus de deux atomes forment des liaisons stables, nous avons besoin d'un modèle plus détaillé. Prenons l'exemple de la molécule d'eau, dans laquelle un atome d'oxygène se lie à deux atomes d'hydrogène. L'oxygène a la configuration électronique 1 s 2 2 s 2 2 p 4, avec deux électrons non appariés (un dans chacune des deux orbitales 2 p). La théorie des liaisons de valence prédirait que les deux liaisons O—H se forment à partir du chevauchement de ces deux orbitales 2 p avec les orbitales 1 s des atomes d'hydrogène. Si tel était le cas, l'angle de liaison serait de 90°, comme le montre la figure\(\PageIndex{1}\), car les orbitales p sont perpendiculaires entre elles. Des preuves expérimentales montrent que l'angle de liaison est de 104,5°, et non de 90°. La prédiction du modèle théorique des liaisons de valence ne correspond pas aux observations réelles d'une molécule d'eau ; un modèle différent est nécessaire.
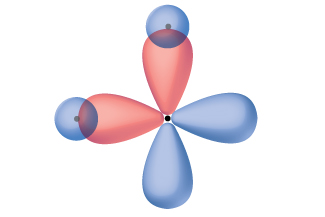
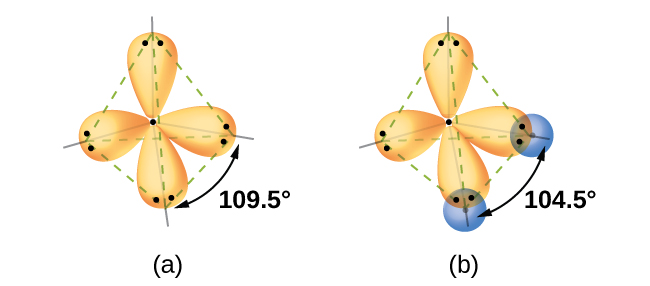
Les calculs de mécanique quantique suggèrent pourquoi les angles de liaison observés dans H 2 O diffèrent de ceux prédits par le chevauchement de l'orbitale 1 s des atomes d'hydrogène avec les orbitales 2 p de l'atome d'oxygène. L'expression mathématique connue sous le nom de fonction d'onde, φ, contient des informations sur chaque orbitale et les propriétés ondulatoires des électrons d'un atome isolé. Lorsque les atomes sont liés entre eux dans une molécule, les fonctions des ondes se combinent pour produire de nouvelles descriptions mathématiques qui ont des formes différentes. Ce processus de combinaison des fonctions d'onde pour les orbitales atomiques est appelé hybridation et est mathématiquement accompli par la combinaison linéaire des orbitales atomiques, LCAO, (une technique que nous retrouverons plus tard). Les nouvelles orbitales qui en résultent sont appelées orbitales hybrides. Les orbitales de valence d'un atome d'oxygène isolé sont une orbitale de 2 s et trois orbitales de 2 p. Les orbitales de valence d'un atome d'oxygène dans une molécule d'eau diffèrent ; elles se composent de quatre orbitales hybrides équivalentes qui pointent approximativement vers les coins d'un tétraèdre (Figure\(\PageIndex{2}\)). Par conséquent, le chevauchement des orbitales O et H devrait donner lieu à un angle de liaison tétraédrique (109,5°). L'angle observé de 104,5° est une preuve expérimentale pour laquelle les calculs de mécanique quantique fournissent une explication utile : la théorie des liaisons de valence doit inclure une composante d'hybridation pour donner des prédictions précises.
Les idées suivantes sont importantes pour comprendre l'hybridation :
- Les orbitales hybrides n'existent pas dans les atomes isolés. Ils se forment uniquement dans des atomes liés par covalence.
- Les orbitales hybrides ont des formes et des orientations très différentes de celles des orbitales atomiques des atomes isolés.
- Un ensemble d'orbitales hybrides est généré en combinant des orbitales atomiques. Le nombre d'orbitales hybrides dans un ensemble est égal au nombre d'orbitales atomiques qui ont été combinées pour produire l'ensemble.
- Toutes les orbitales d'un ensemble d'orbitales hybrides ont une forme et une énergie équivalentes.
- Le type d'orbitales hybrides formées dans un atome lié dépend de la géométrie de sa paire d'électrons, telle que prédite par la théorie VSEPR.
- Les orbitales hybrides se chevauchent pour former des liaisons σ. Les orbitales non hybridées se chevauchent pour former des liaisons π.
Dans les sections suivantes, nous aborderons les types courants d'orbitales hybrides.
sp. Hybridation
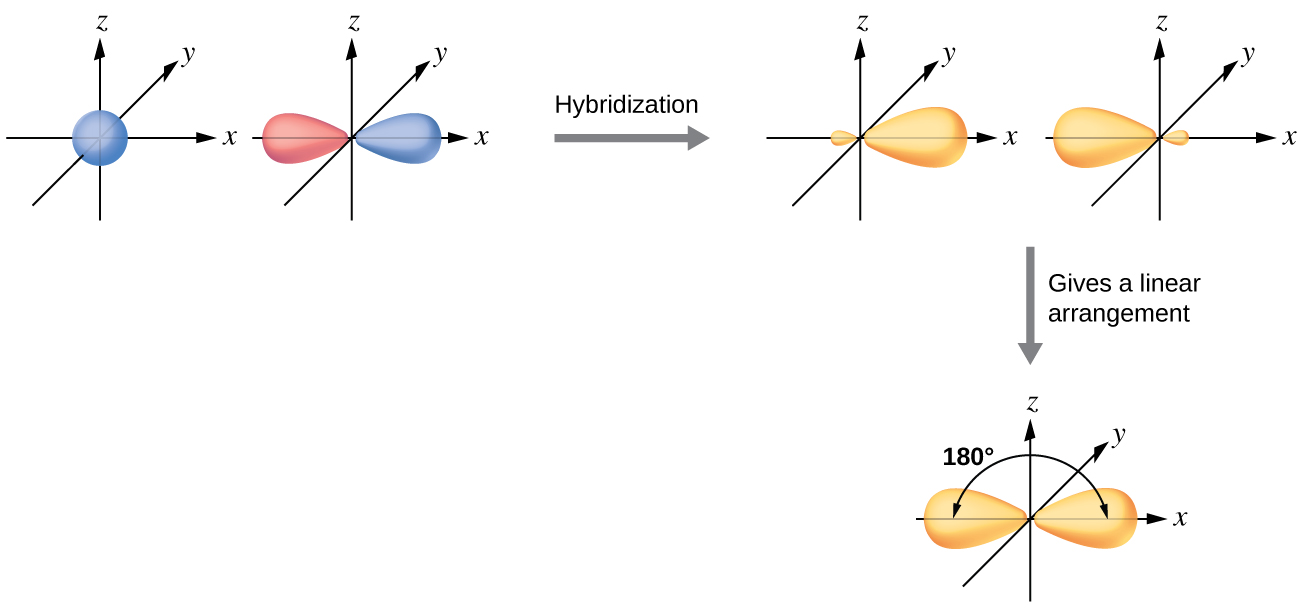
L'atome de béryllium d'une molécule gazeuse de BeCl 2 est un exemple d'atome central dépourvu de paires d'électrons dans un arrangement linéaire de trois atomes. Il existe deux régions de densité électronique de valence dans la molécule de BeCl 2 qui correspondent aux deux liaisons covalentes Be—Cl. Pour tenir compte de ces deux domaines électroniques, deux des quatre orbitales de valence de l'atome de Be se mélangeront pour produire deux orbitales hybrides. Ce processus d'hybridation implique le mélange de l'orbitale de valence s avec l'une des orbitales de valence p pour obtenir deux orbitales hybrides sp équivalentes orientées selon une géométrie linéaire (Figure\(\PageIndex{3}\)). Sur cette figure, l'ensemble des orbitales sp semble avoir une forme similaire à celle de l'orbitale p d'origine, mais il existe une différence importante. Le nombre d'orbitales atomiques combinées est toujours égal au nombre d'orbitales hybrides formées. L'orbitale p est une orbitale qui peut contenir jusqu'à deux électrons. L'ensemble sp est constitué de deux orbitales équivalentes pointant à 180° l'une de l'autre. Les deux électrons qui se trouvaient à l'origine sur l'orbitale s sont maintenant distribués sur les deux orbitales sp, qui sont à moitié remplies. Dans le BeCl 2 gazeux, ces orbitales hybrides à moitié remplies se chevaucheront avec les orbitales des atomes de chlore pour former deux liaisons σ identiques.
Nous illustrons les différences électroniques entre un atome de Be isolé et un atome de Be lié dans le diagramme des niveaux d'énergie orbitaux de la Figure\(\PageIndex{4}\). Ces diagrammes représentent chaque orbite par une ligne horizontale (indiquant son énergie) et chaque électron par une flèche. L'énergie augmente vers le haut du diagramme. Nous utilisons une flèche vers le haut pour indiquer un électron sur une orbitale et deux flèches (haut et bas) pour indiquer deux électrons de spin opposé.
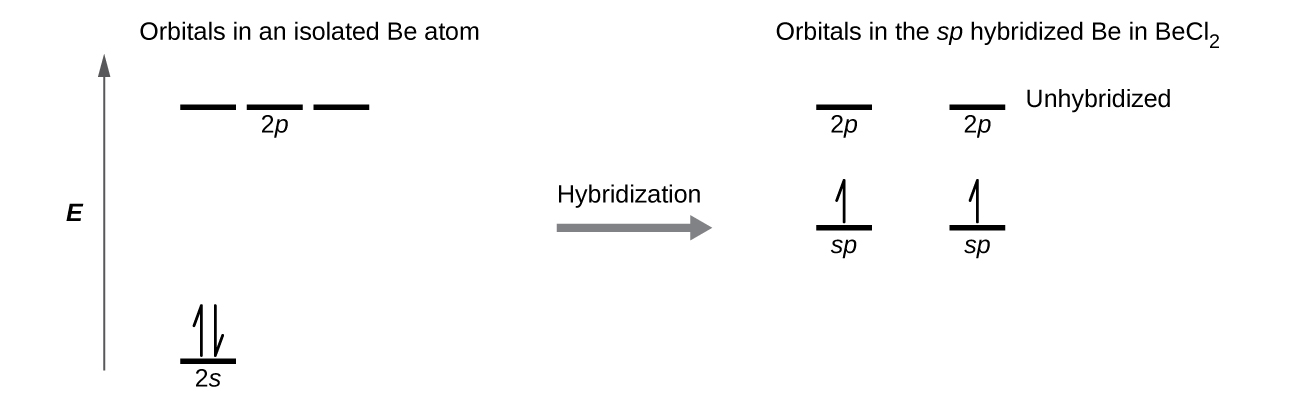
Lorsque les orbitales atomiques s'hybrident, les électrons de valence occupent les orbitales nouvellement créées. L'atome Be avait deux électrons de valence, de sorte que chacune des orbitales sp reçoit l'un de ces électrons. Chacun de ces électrons s'associe à l'électron non apparié d'un atome de chlore lorsqu'une orbitale hybride et une orbitale de chlore se chevauchent lors de la formation des liaisons Be-Cl. Tout atome central entouré de seulement deux régions de densité électronique de valence dans une molécule présentera une hybridation sp. D'autres exemples incluent l'atome de mercure dans la molécule linéaire de HgCl 2, l'atome de zinc dans le Zn (CH 3) 2, qui contient un arrangement linéaire C—Zn—C, et les atomes de carbone dans le HCCH et le CO 2.
sp 2 Hybridation
Les orbitales de valence d'un atome central entouré de trois régions de densité électronique sont constituées d'un ensemble de trois orbitales hybrides sp 2 et d'une orbitale p non hybridée. Cet arrangement résulte de l'hybridation sp 2, du mélange d'une orbitale s et de deux orbitales p pour produire trois orbitales hybrides identiques orientées selon une géométrie plane trigonale (Figure\(\PageIndex{5}\)).
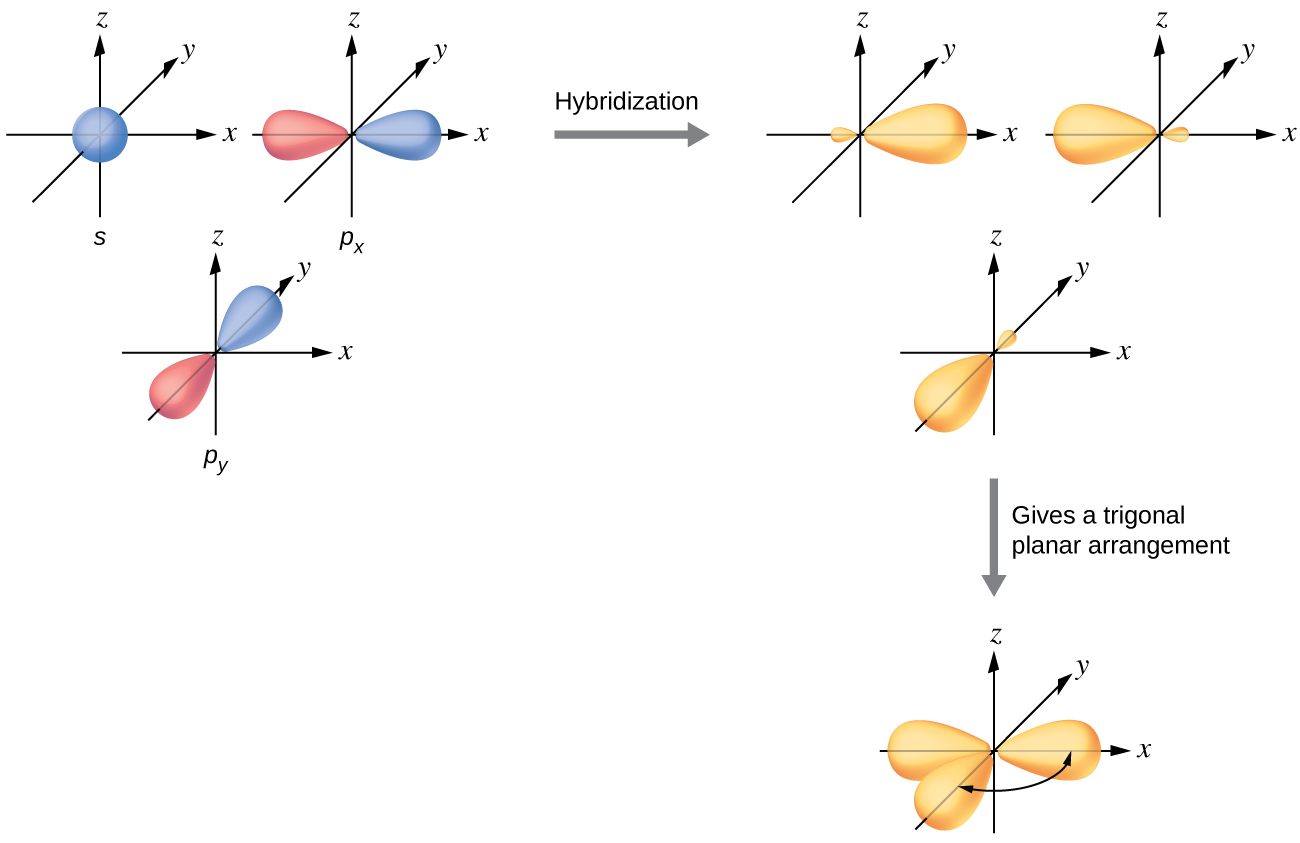
Bien que la mécanique quantique produise les lobes orbitaux « dodus » tels que représentés sur la figure\(\PageIndex{5}\), parfois, pour des raisons de clarté, ces orbitales sont dessinées plus finement et sans les lobes mineurs, comme sur la figure\(\PageIndex{6}\), pour éviter de masquer d'autres caractéristiques d'une illustration donnée. Nous utiliserons ces représentations « plus fines » chaque fois que la vue réelle est trop dense pour être facilement visualisée.
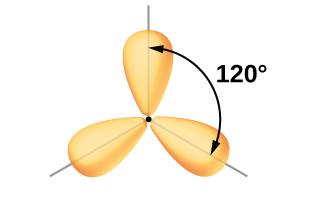
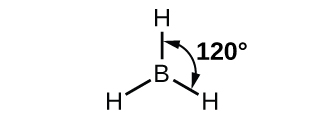
La structure observée de la molécule de borane, BH 3, suggère une hybridation sp 2 pour le bore dans ce composé. La molécule est plane trigonale et l'atome de bore est impliqué dans trois liaisons avec les atomes d'hydrogène (Figure\(\PageIndex{7}\)).
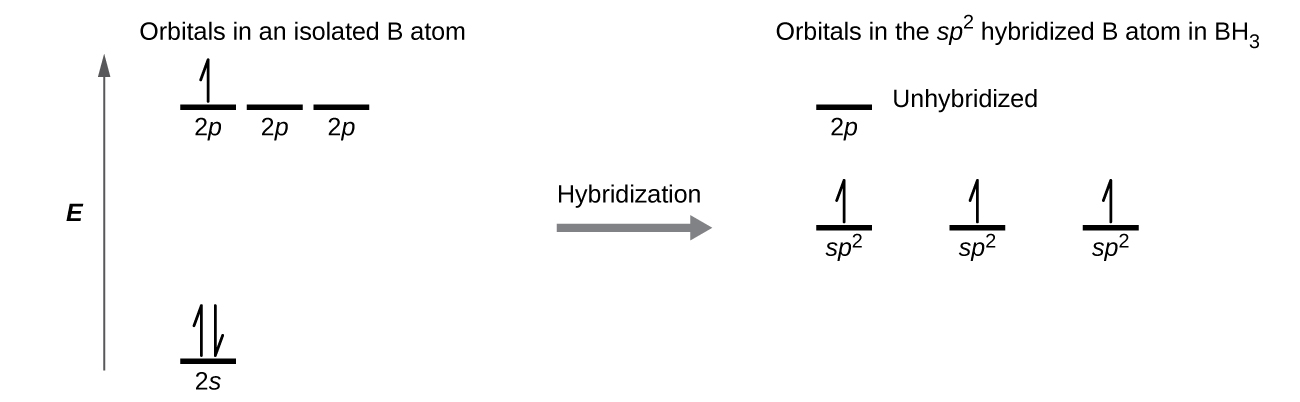
Nous pouvons illustrer la comparaison des orbitales et de la distribution des électrons dans un atome de bore isolé et dans l'atome lié dans BH 3, comme le montre le diagramme des niveaux d'énergie orbitaux de la Figure\(\PageIndex{8}\). Nous redistribuons les trois électrons de valence de l'atome de bore dans les trois orbitales hybrides sp 2, et chaque électron de bore est apparié à un électron hydrogène lorsque des liaisons B—H se forment.
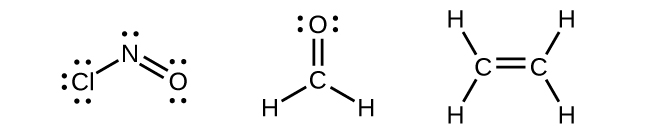
Tout atome central entouré de trois régions de densité électronique présentera une hybridation sp 2. Cela inclut les molécules ayant une paire unique sur l'atome central, comme le ClNO (Figure\(\PageIndex{9}\)), ou les molécules ayant deux liaisons simples et une double liaison connectées à l'atome central, comme dans le formaldéhyde, le CH 2 O, et l'éthylène, le H 2 CCH 2 2.
sp 3 Hybridation
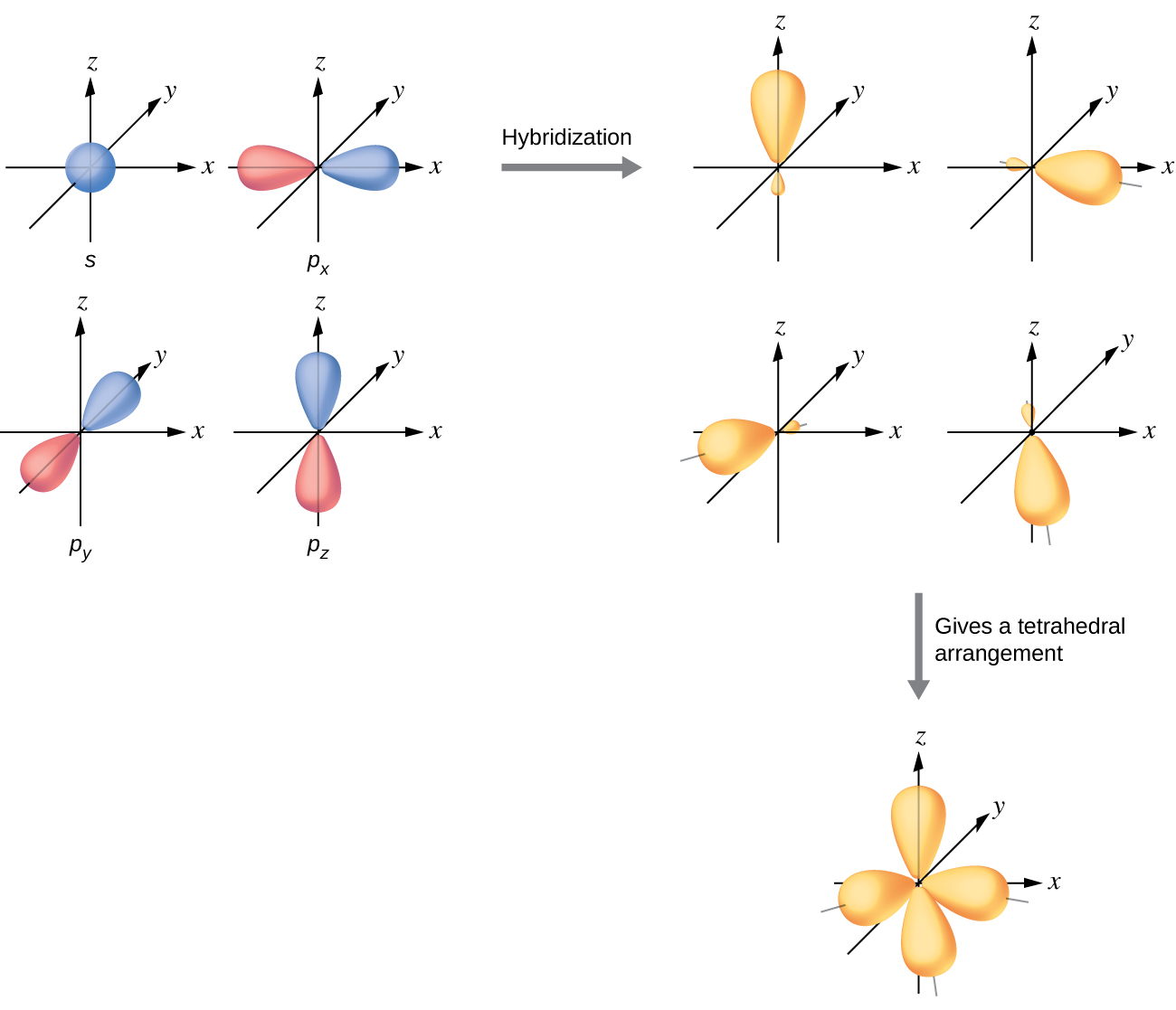
Les orbitales de valence d'un atome entouré d'un arrangement tétraédrique de paires de liaisons et de paires isolées consistent en un ensemble de quatre orbitales hybrides sp 3. Les hybrides résultent du mélange d'une orbitale s et des trois orbitales p, ce qui produit quatre orbitales hybrides sp 3 identiques (Figure\(\PageIndex{10}\)). Chacune de ces orbitales hybrides pointe vers un angle différent d'un tétraèdre.
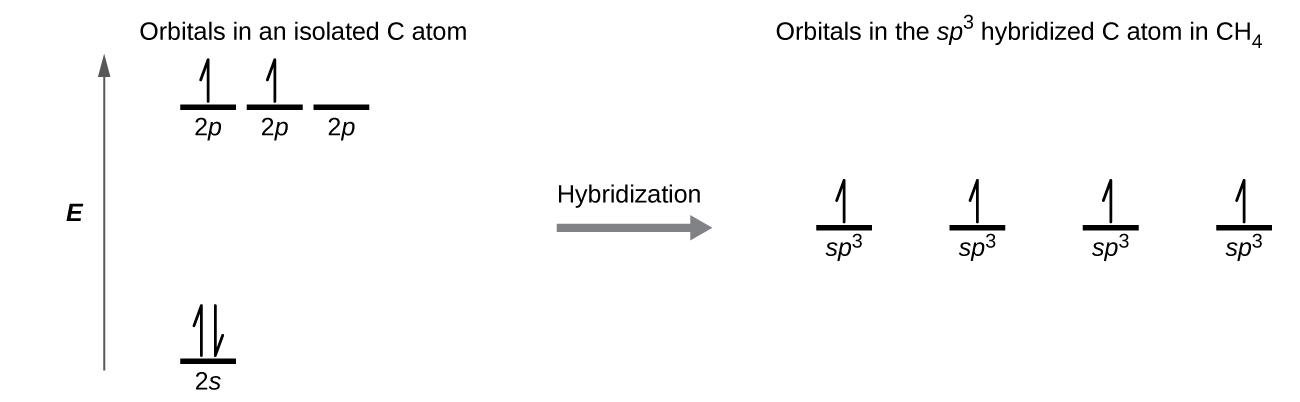
Une molécule de méthane, le CH 4, est constituée d'un atome de carbone entouré de quatre atomes d'hydrogène aux angles d'un tétraèdre. L'atome de carbone du méthane présente une hybridation sp 3. Nous illustrons les orbitales et la distribution des électrons dans un atome de carbone isolé et dans l'atome lié du CH 4 sur la figure\(\PageIndex{11}\). Les quatre électrons de valence de l'atome de carbone sont répartis de manière égale dans les orbitales hybrides, et chaque électron de carbone est apparié à un électron hydrogène lorsque les liaisons C—H se forment.
Dans une molécule de méthane, l'orbitale 1 s de chacun des quatre atomes d'hydrogène chevauche l'une des quatre orbitales sp 3 de l'atome de carbone pour former une liaison sigma (σ). Il en résulte la formation de quatre liaisons covalentes fortes et équivalentes entre l'atome de carbone et chacun des atomes d'hydrogène pour produire la molécule de méthane, le CH 4.
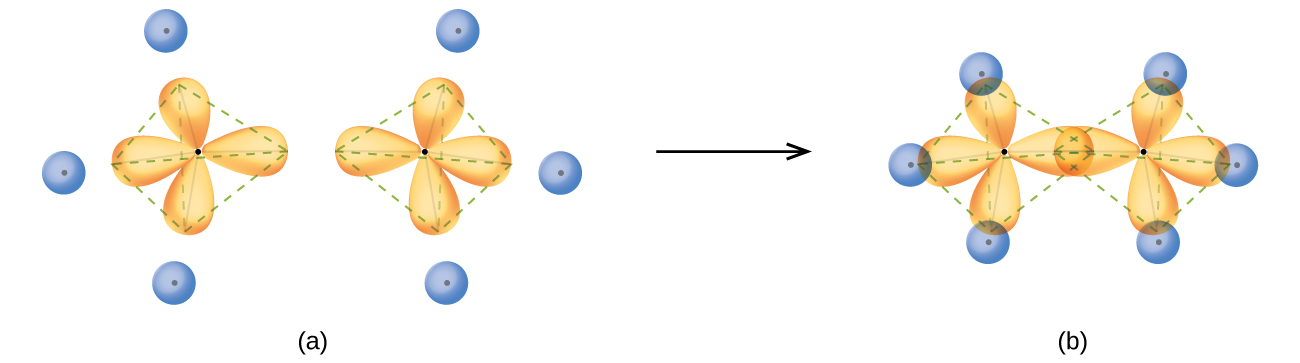
La structure de l'éthane, C 2 H 6, est similaire à celle du méthane en ce sens que chaque carbone de l'éthane possède quatre atomes voisins disposés aux coins d'un tétraèdre : trois atomes d'hydrogène et un atome de carbone (Figure\(\PageIndex{10}\)). Cependant, dans l'éthane, une orbitale sp 3 d'un atome de carbone se chevauche bout à bout avec une orbitale sp 3 d'un second atome de carbone pour former une liaison σ entre les deux atomes de carbone. Chacune des orbitales hybrides sp 3 restantes chevauche l'orbitale s d'un atome d'hydrogène pour former des liaisons σ carbone—hydrogène. La structure et le contour général des orbitales de liaison de l'éthane sont illustrés sur la figure\(\PageIndex{12}\). L'orientation des deux groupes CH 3 n'est pas fixe l'un par rapport à l'autre. Des preuves expérimentales montrent que la rotation autour des liaisons σ se produit facilement.
Une orbitale hybride sp 3 peut également contenir une seule paire d'électrons. Par exemple, l'atome d'azote de l'ammoniac est entouré de trois paires de liaisons et d'une seule paire d'électrons dirigés vers les quatre coins d'un tétraèdre. L'atome d'azote est un atome sp 3 hybridé avec une orbitale hybride occupée par la paire isolée.
La structure moléculaire de l'eau est compatible avec un arrangement tétraédrique composé de deux paires isolées et de deux paires d'électrons se liant. Ainsi, nous disons que l'atome d'oxygène est hybridé sp 3, deux des orbitales hybrides étant occupées par des paires isolées et deux par des paires de liaison. Comme les paires isolées occupent plus d'espace que les paires de liaisons, les structures qui contiennent des paires isolées présentent des angles de liaison légèrement déformés par rapport à l'idéal. Les tétraèdres parfaits ont des angles de 109,5°, mais les angles observés dans l'ammoniac (107,3°) et dans l'eau (104,5°) sont légèrement plus petits. D'autres exemples d'hybridation de la sp 3 incluent le CCl 4, le pCl 3 et le NCl 3.
Hybridation sp 3 d et sp 3 d 2
Pour décrire les cinq orbitales de liaison dans un arrangement bipyramidal trigonal, nous devons utiliser cinq des orbitales atomiques de la couche de valence (l'orbitale s, les trois orbitales p et l'une des orbitales d), ce qui donne cinq sp 3 d orbitales hybrides. Avec un arrangement octaédrique de six orbitales hybrides, nous devons utiliser six orbitales atomiques à couche de valence (l'orbitale s, les trois orbitales p et deux des orbitales d dans sa couche de valence), ce qui donne six sp 3 d 2 orbitales hybrides. Ces hybridations ne sont possibles que pour les atomes qui ont des orbitales d dans leur sous-couche de valence (c'est-à-dire pas ceux de la première ou de la deuxième période).

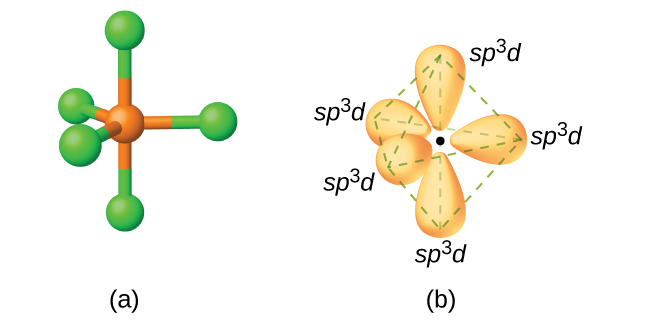
Dans une molécule de pentachlorure de phosphore, PcL 5, se trouvent cinq liaisons P—Cl (donc cinq paires d'électrons de valence autour de l'atome de phosphore) dirigées vers les coins d'une bipyramide trigonale. Nous utilisons l'orbitale 3 s, les trois orbitales 3 p et l'une des orbitales 3 d pour former l'ensemble des cinq orbitales hybrides sp 3 d (Figure\(\PageIndex{13}\)) impliquées dans les liaisons P—Cl. Les autres atomes qui présentent une hybridation sp 3 d incluent l'atome de soufre dans le SF 4 et les atomes de chlore dans le ClF 3 et dans\(\ce{ClF4+}\). (Les électrons des atomes de fluor sont omis pour des raisons de clarté.)
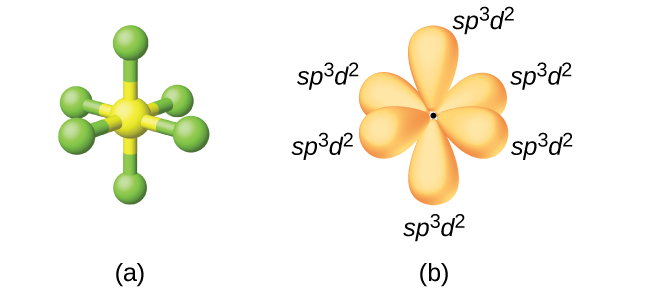
L'atome de soufre dans l'hexafluorure de soufre, SF 6, présente une hybridation sp 3 d 2. Une molécule d'hexafluorure de soufre possède six paires d'électrons liant six atomes de fluor à un seul atome de soufre. Il n'y a pas de paires d'électrons isolées sur l'atome central. Pour lier six atomes de fluor, l'orbitale 3 s, les trois orbitales 3 p et deux des orbitales 3 d forment six orbitales hybrides sp 3 d 2 équivalentes, chacune dirigée vers un coin différent d'un octaèdre. Les autres atomes qui présentent une hybridation sp 3 d 2 incluent l'atome de phosphore dans\(\ce{PCl6-}\), l'atome d'iode dans les interhalogènes\(\ce{IF6+}\), IF 5\(\ce{ICl4-}\),\(\ce{IF4-}\) et l'atome de xénon dans XeF 4.
Affectation d'orbitales hybrides à des atomes centraux
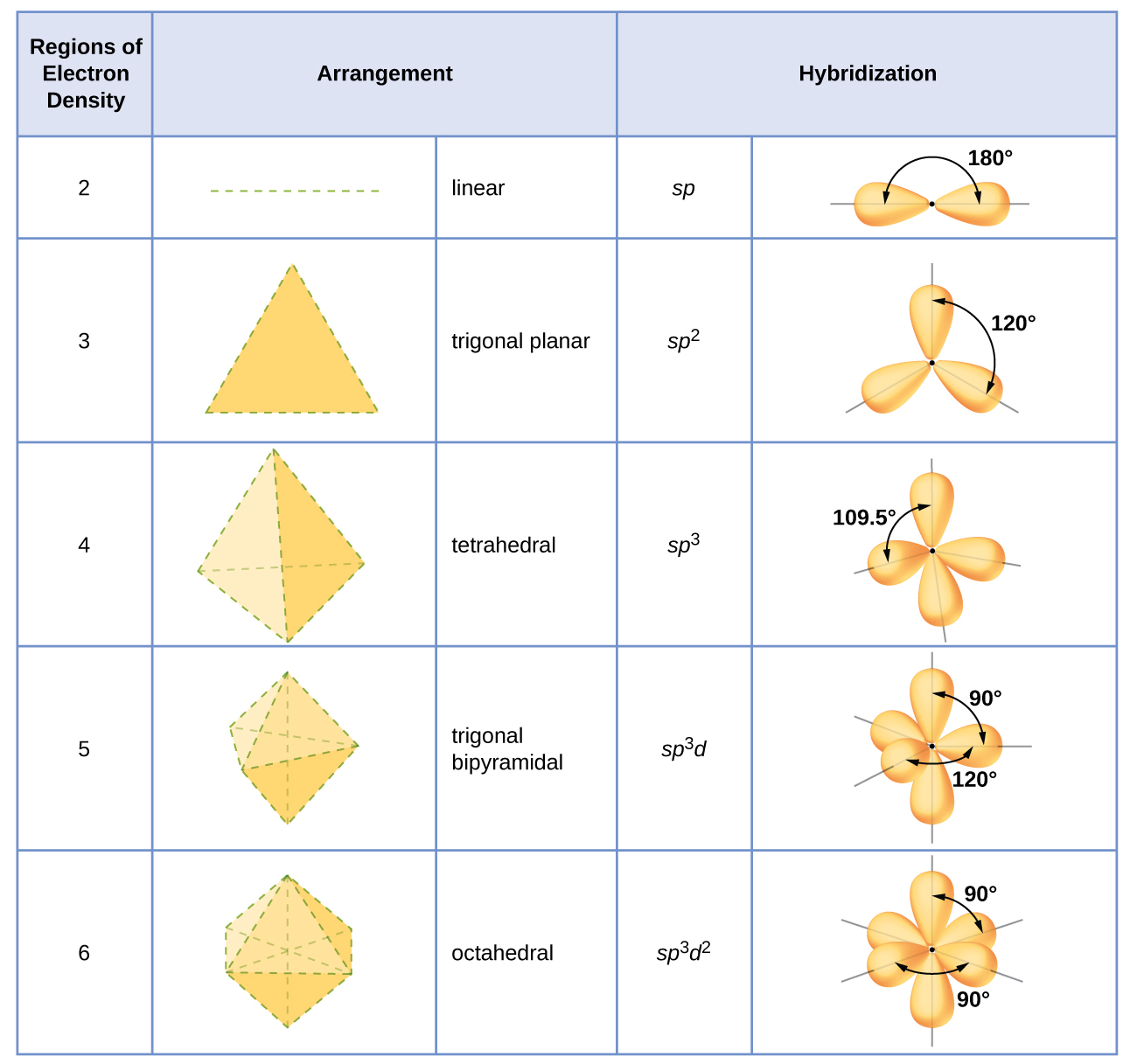
L'hybridation d'un atome est déterminée en fonction du nombre de régions de densité électronique qui l'entourent. Les arrangements géométriques caractéristiques des différents ensembles d'orbitales hybrides sont illustrés sur la figure\(\PageIndex{16}\). Ces arrangements sont identiques à ceux des géométries de paires d'électrons prédites par la théorie VSEPR. La théorie de la VSEPR prédit les formes des molécules, et la théorie des orbites hybrides fournit une explication de la façon dont ces formes se forment. Pour déterminer l'hybridation d'un atome central, nous pouvons utiliser les directives suivantes :
- Déterminez la structure de Lewis de la molécule.
- Déterminez le nombre de régions de densité électronique autour d'un atome à l'aide de la théorie VSEPR, dans laquelle les liaisons simples, les liaisons multiples, les radicaux et les paires isolées comptent chacune pour une région.
- Attribuez l'ensemble des orbitales hybrides de la figure\(\PageIndex{16}\) qui correspond à cette géométrie.
Il est important de se rappeler que l'hybridation a été conçue pour rationaliser les géométries moléculaires observées expérimentalement, et non l'inverse.
Le modèle fonctionne bien pour les molécules contenant de petits atomes centraux, dans lesquelles les paires d'électrons de valence sont proches les unes des autres dans l'espace. Cependant, pour les atomes centraux plus gros, les paires d'électrons valence-enveloppe sont plus éloignées du noyau et il y a moins de répulsions. Leurs composés présentent des structures qui ne sont souvent pas conformes à la théorie de la VSEPR, et des orbitales hybridées ne sont pas nécessaires pour expliquer les données observées.
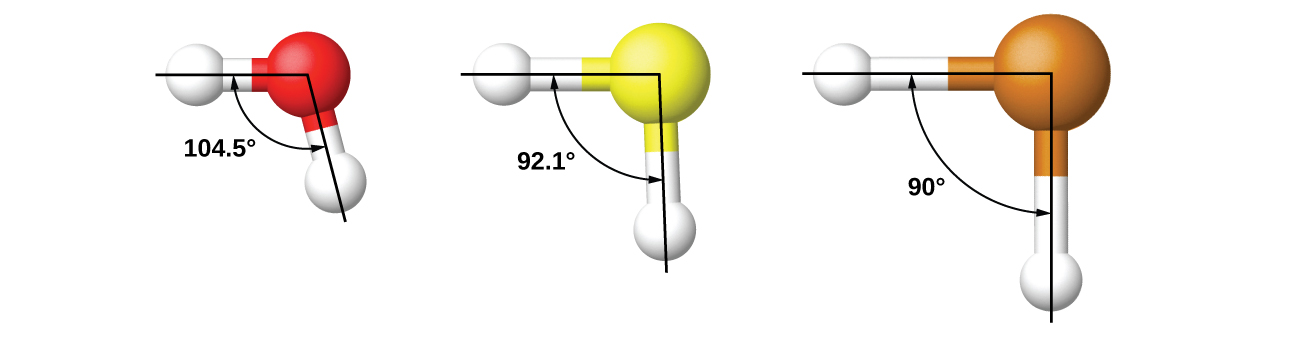
Par exemple, nous avons discuté de l'angle de liaison H—O—H dans H 2 O, 104,5°, qui est plus cohérent avec les orbitales hybrides sp 3 (109,5°) sur l'atome central qu'avec les orbitales 2p (90°). Le soufre appartient au même groupe que l'oxygène et l'H 2 S a une structure de Lewis similaire. Cependant, son angle de liaison est beaucoup plus petit (92,1°), ce qui indique une hybridation beaucoup moins importante sur le soufre que sur l'oxygène. En continuant vers le bas du groupe, le tellure est encore plus gros que le soufre, et pour H 2 Te, l'angle de liaison observé (90°) correspond à un chevauchement des orbitales 5 p, sans qu'il y ait d'hybridation. Nous invoquons l'hybridation lorsqu'il est nécessaire d'expliquer les structures observées.
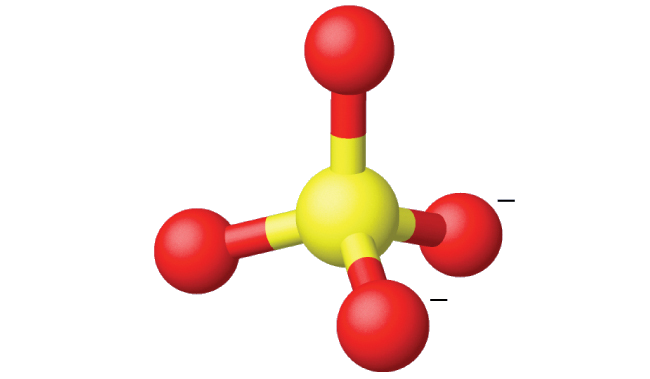
Ammonium sulfate is important as a fertilizer. What is the hybridization of the sulfur atom in the sulfate ion, \(\ce{SO4^2-}\)?
Solution
The Lewis structure of sulfate shows there are four regions of electron density.
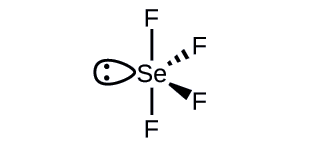
What is the hybridization of the selenium atom in SeF4?
- Answer
-
The selenium atom is sp3d hybridized.
Urea, NH2C(O)NH2, is sometimes used as a source of nitrogen in fertilizers. What is the hybridization of each nitrogen and carbon atom in urea?
Solution
The Lewis structure of urea is
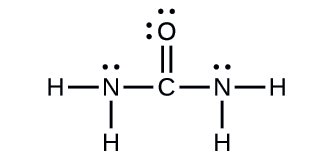
The carbon atom is surrounded by three regions of electron density, positioned in a trigonal planar arrangement. The hybridization in a trigonal planar electron pair geometry is sp2 (Figure \(\PageIndex{16}\)), which is the hybridization of the carbon atom in urea.
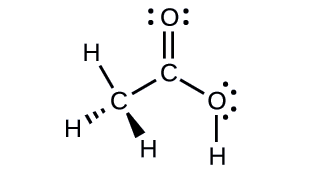
Acetic acid, H3CC(O)OH, is the molecule that gives vinegar its odor and sour taste. What is the hybridization of the two carbon atoms in acetic acid?
- Answer
-
H3C, sp3; C(O)OH, sp2
Summary
We can use hybrid orbitals, which are mathematical combinations of some or all of the valence atomic orbitals, to describe the electron density around covalently bonded atoms. These hybrid orbitals either form sigma (σ) bonds directed toward other atoms of the molecule or contain lone pairs of electrons. We can determine the type of hybridization around a central atom from the geometry of the regions of electron density about it. Two such regions imply sp hybridization; three, sp2 hybridization; four, sp3 hybridization; five, sp3d hybridization; and six, sp3d2 hybridization. Pi (π) bonds are formed from unhybridized atomic orbitals (p or d orbitals).
Footnotes
- Note that orbitals may sometimes be drawn in an elongated “balloon” shape rather than in a more realistic “plump” shape in order to make the geometry easier to visualize.
Glossary
- hybrid orbital
- orbital created by combining atomic orbitals on a central atom
- hybridization
- model that describes the changes in the atomic orbitals of an atom when it forms a covalent compound
- sp hybrid orbital
- one of a set of two orbitals with a linear arrangement that results from combining one s and one p orbital
- sp2 hybrid orbital
- one of a set of three orbitals with a trigonal planar arrangement that results from combining one s and two p orbitals
- sp3 hybrid orbital
- one of a set of four orbitals with a tetrahedral arrangement that results from combining one s and three p orbitals
- sp3d hybrid orbital
- one of a set of five orbitals with a trigonal bipyramidal arrangement that results from combining one s, three p, and one d orbital
- sp3d2 hybrid orbital
- one of a set of six orbitals with an octahedral arrangement that results from combining one s, three p, and two d orbitals


