8.1 : Théorie des liaisons de valence
- Page ID
- 193894
- Décrire la formation de liaisons covalentes en termes de superposition orbitale atomique
- Définissez et donnez des exemples de liaisons σ et π
Comme nous le savons, une théorie scientifique est une explication solidement étayée des lois naturelles observées ou de vastes ensembles de données expérimentales. Pour qu'une théorie soit acceptée, elle doit expliquer des données expérimentales et être capable de prédire le comportement. Par exemple, la théorie de la VSEPR est largement acceptée parce qu'elle prédit des formes moléculaires tridimensionnelles qui sont cohérentes avec les données expérimentales collectées pour des milliers de molécules différentes. Cependant, la théorie du VSEPR ne fournit pas d'explication de la liaison chimique.
Il existe des théories réussies qui décrivent la structure électronique des atomes. Nous pouvons utiliser la mécanique quantique pour prédire les régions spécifiques autour d'un atome où les électrons sont susceptibles de se trouver : une forme sphérique pour une orbitale s, une forme d'haltère pour une orbitale p, etc. Cependant, ces prédictions ne décrivent que les orbitales autour des atomes libres. Lorsque les atomes se lient pour former des molécules, les orbitales atomiques ne sont pas suffisantes pour décrire les régions où les électrons seront situés dans la molécule. Une compréhension plus complète de la distribution des électrons nécessite un modèle capable de rendre compte de la structure électronique des molécules. Selon une théorie populaire, une liaison covalente se forme lorsqu'une paire d'électrons est partagée par deux atomes et est simultanément attirée par les noyaux des deux atomes. Dans les sections suivantes, nous verrons comment ces liaisons sont décrites par la théorie des liaisons de valence et l'hybridation.
La théorie des liaisons de valence décrit une liaison covalente comme la superposition d'orbitales atomiques à moitié remplies (chacune contenant un seul électron) qui produit une paire d'électrons partagée entre les deux atomes liés. Nous disons que les orbitales de deux atomes différents se chevauchent lorsqu'une partie d'une orbitale et une partie d'une seconde orbitale occupent la même région de l'espace. Selon la théorie des liaisons de valence, une liaison covalente se produit lorsque deux conditions sont remplies :
- une orbitale sur un atome chevauche une orbitale sur un deuxième atome et
- les électrons individuels de chaque orbite se combinent pour former une paire d'électrons.
L'attraction mutuelle entre cette paire d'électrons chargés négativement et les noyaux chargés positivement des deux atomes sert à relier physiquement les deux atomes par une force que nous définissons comme une liaison covalente. La force d'une liaison covalente dépend du degré de chevauchement des orbitales impliquées. Les orbitales qui se chevauchent largement forment des liaisons plus solides que celles qui se chevauchent moins.
L'énergie du système dépend de la mesure dans laquelle les orbitales se chevauchent. La figure\(\PageIndex{1}\) montre comment la somme des énergies de deux atomes d'hydrogène (la courbe colorée) change lorsqu'ils se rapprochent l'un de l'autre. Lorsque les atomes sont éloignés, il n'y a pas de chevauchement et, par convention, nous fixons la somme des énergies à zéro. Lorsque les atomes se déplacent ensemble, leurs orbitales commencent à se chevaucher. Chaque électron commence à ressentir l'attraction du noyau dans l'autre atome. De plus, les électrons commencent à se repousser, tout comme les noyaux. Bien que les atomes soient encore largement séparés, les attractions sont légèrement plus fortes que les répulsions et l'énergie du système diminue. (Un lien commence à se former.) À mesure que les atomes se rapprochent, le chevauchement augmente, de sorte que l'attraction des noyaux pour les électrons continue d'augmenter (tout comme les répulsions entre les électrons et entre les noyaux). À une certaine distance entre les atomes, qui varie en fonction des atomes impliqués, l'énergie atteint sa valeur la plus basse (la plus stable). Cette distance optimale entre les deux noyaux liés est la distance de liaison entre les deux atomes. La liaison est stable car à ce stade, les forces d'attraction et de répulsion se combinent pour créer la configuration énergétique la plus faible possible. Si la distance entre les noyaux devait encore diminuer, les répulsions entre les noyaux et les répulsions causées par le fait que les électrons sont confinés à proximité les uns des autres deviendraient plus fortes que les forces d'attraction. L'énergie du système augmenterait alors (déstabilisant le système), comme indiqué à l'extrême gauche de la Figure\(\PageIndex{1}\).
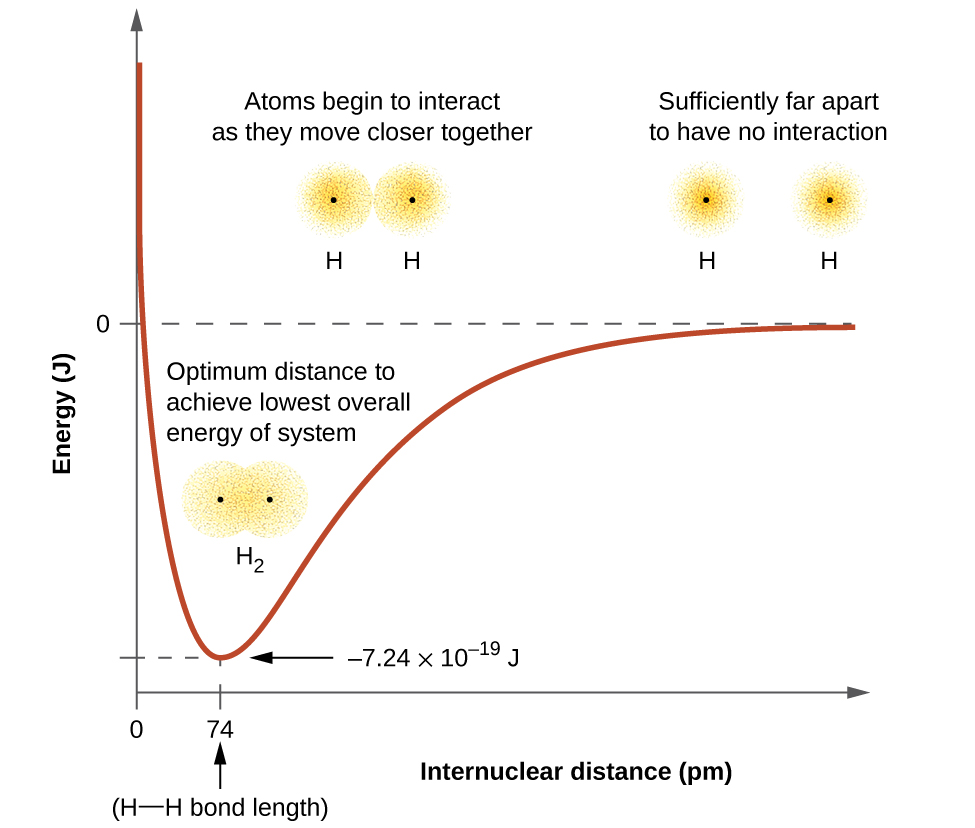
L'énergie de liaison est la différence entre l'énergie minimale (qui se produit à la distance de liaison) et l'énergie des deux atomes séparés. Il s'agit de la quantité d'énergie libérée lors de la formation de la liaison. À l'inverse, la même quantité d'énergie est nécessaire pour rompre la liaison. Pour la\(H_2\) molécule illustrée à la figure\(\PageIndex{1}\), à la distance de liaison de 74 pm, le système a une énergie\(7.24 \times 10^{−19}\, J\) inférieure à celle des deux atomes d'hydrogène séparés. Ce chiffre peut sembler petit. Cependant, notre description antérieure de la thermochimie nous a appris que les énergies de liaison sont souvent discutées par mole. Par exemple, il\(7.24 \times 10^{−19}\; J\) faut rompre une liaison H—H, mais il\(4.36 \times 10^5\; J\) faut casser 1 mole de liaisons H—H. Une comparaison de certaines longueurs et énergies de liaison est présentée dans le tableau\(\PageIndex{1}\). Nous pouvons trouver bon nombre de ces liaisons dans diverses molécules, et ce tableau fournit des valeurs moyennes. Par exemple, la rupture de la première liaison C—H dans le CH4 nécessite 439,3 kJ/mol, tandis que la rupture de la première liaison C—H dans\(\ce{H–CH2C6H5}\) (un diluant à peinture courant) nécessite 375,5 kJ/mol.
| Bond | Longueur (pm) | Énergie (kJ/mol) | Bond | Longueur (pm) | Énergie (kJ/mol) | |
|---|---|---|---|---|---|---|
| H—H | 74 | 436 | C—O | 140,1 | 358 | |
| H—C | 106,8 | 413 | \(\mathrm{C=O}\) | 119,7 | 745 | |
| H—N | 101,5 | 391 | \(\mathrm{C≡O}\) | 113,7 | 1072 | |
| H—O | 97,5 | 467 | H—Cl | 127,5 | 431 | |
| C-C | 150,6 | 347 | H—Br | 141,4 | 366 | |
| \(\mathrm{C=C}\) | 133,5 | 614 | H—I | 160,9 | 298 | |
| \(\mathrm{C≡C}\) | 120,8 | 839 | O—O | 148 | 146 | |
| C-N | 142,1 | 305 | \(\mathrm{O=O}\) | 120,8 | 498 | |
| \(\mathrm{C=N}\) | 130,0 | 615 | F—F | 141,2 | 159 | |
| \(\mathrm{C≡N}\) | 116.1 | 891 | Cl—Cl | 198,8 | 243 |
Outre la distance entre deux orbitales, l'orientation des orbitales affecte également leur chevauchement (sauf pour deux orbitales s, qui sont sphériquement symétriques). Un plus grand chevauchement est possible lorsque les orbitales sont orientées de telle sorte qu'elles se chevauchent sur une ligne directe entre les deux noyaux. La figure\(\PageIndex{2}\) illustre cela pour deux orbitales p provenant d'atomes différents ; le chevauchement est plus important lorsque les orbitales se chevauchent bout à bout plutôt que selon un angle.
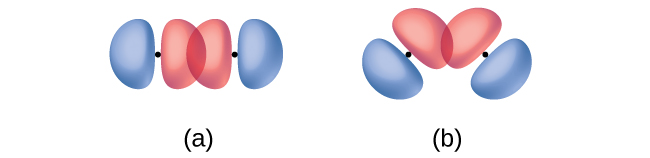
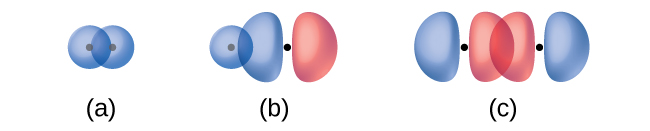
Le chevauchement de deux orbitales s (comme dans H 2), le chevauchement d'une orbitale s et d'une orbitale p (comme dans HCl) et le chevauchement de bout en bout de deux orbitales p (comme dans Cl 2) produisent tous des liaisons sigma (liaisons σ), comme illustré dans la Figure \(\PageIndex{3}\). Une liaison σ est une liaison covalente dans laquelle la densité électronique est concentrée dans la région le long de l'axe internucléaire ; c'est-à-dire qu'une ligne entre les noyaux passerait par le centre de la région de chevauchement. Les liaisons simples dans les structures de Lewis sont décrites comme des liaisons σ dans la théorie des liaisons de valence.
Une liaison pi (liaison π) est un type de liaison covalente qui résulte du chevauchement côte à côte de deux orbitales p, comme illustré sur la Figure\(\PageIndex{4}\). Dans une liaison π, les régions de chevauchement orbital se situent de part et d'autre de l'axe internucléaire. Le long de l'axe lui-même, il y a un nœud, c'est-à-dire un plan sans probabilité de trouver un électron.
 « style="largeur : 325 px ; hauteur : 115 px ; » width="325px » height="115px » src= »/@api /deki/files/56400/CNX_Chem_08_01_pi.jpg « >
« style="largeur : 325 px ; hauteur : 115 px ; » width="325px » height="115px » src= »/@api /deki/files/56400/CNX_Chem_08_01_pi.jpg « >
Alors que toutes les liaisons simples sont des liaisons σ, les liaisons multiples se composent à la fois de liaisons σ et de liaisons π. Comme le suggèrent les structures de Lewis, O 2 contient une double liaison et N 2 contient une triple liaison. La double liaison est constituée d'une liaison σ et d'une liaison π, et la triple liaison est constituée d'une liaison σ et de deux liaisons π. Entre deux atomes quelconques, la première liaison formée sera toujours une liaison σ, mais il ne peut y avoir qu'une seule liaison σ à un endroit donné. Dans toute liaison multiple, il y aura une liaison σ et la ou les deux liaisons restantes seront des liaisons π. Ces liens sont décrits plus en détail plus loin dans ce chapitre.
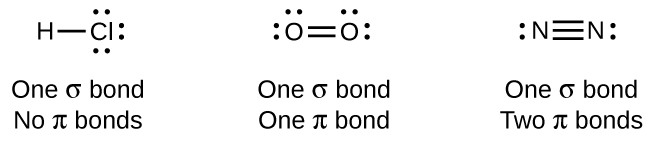
Comme le montre le tableau\(\PageIndex{1}\), une liaison simple carbone-carbone moyenne est de 347 kJ/mol, tandis que dans une double liaison carbone-carbone, la liaison π augmente la force de liaison de 267 kJ/mol. L'ajout d'une liaison π supplémentaire entraîne une nouvelle augmentation de 225 kJ/mol. Nous pouvons observer un schéma similaire lorsque nous comparons d'autres liaisons σ et π. Ainsi, chaque liaison π individuelle est généralement plus faible qu'une liaison σ correspondante entre les deux mêmes atomes. Dans une liaison σ, le degré de chevauchement orbital est plus important que dans une liaison π.
Le butadiène, C 4 H 6, est utilisé pour fabriquer du caoutchouc synthétique. Identifiez le nombre de liaisons σ et π contenues dans cette molécule.
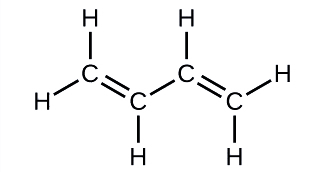
Solution
Il existe six liaisons σ C—H et une liaison σ C—C, soit un total de sept liaisons simples. Il existe deux doubles liaisons qui ont chacune une liaison π en plus de la liaison σ. Cela donne un total de neuf liaisons σ et deux liaisons π au total.
Identifiez chaque illustration comme représentant une liaison σ ou π :
- chevauchement côte à côte d'une orbitale 4 p et d'une orbitale 2 p
- chevauchement de bout en bout d'une orbitale 4p et 4p
- chevauchement de bout en bout d'une orbitale 4 p et d'une orbitale 2 p
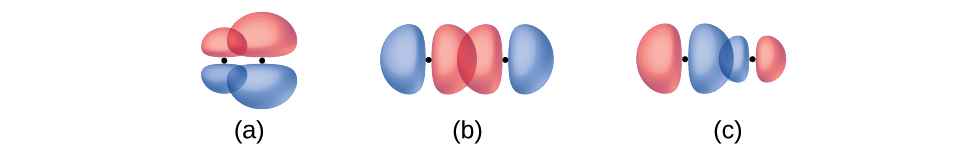
- Réponse
-
(a) est une liaison π avec un nœud le long de l'axe reliant les noyaux tandis que (b) et (c) sont des liaisons σ qui se chevauchent le long de l'axe.
Résumé
La théorie des liaisons de valence décrit la liaison comme une conséquence du chevauchement de deux orbitales atomiques distinctes sur des atomes différents, créant ainsi une région dans laquelle une paire d'électrons est partagée entre les deux atomes. Lorsque les orbitales se chevauchent le long d'un axe contenant les noyaux, elles forment une liaison σ. Lorsqu'elles se chevauchent de manière à créer un nœud le long de cet axe, elles forment une liaison π.
Lexique
- chevauchement
- coexistence d'orbitales provenant de deux atomes différents partageant la même région de l'espace, conduisant à la formation d'une liaison covalente
- nœud
- plan séparant les différents lobes des orbitales, où la probabilité de trouver un électron est nulle
- liaison pi (liaison π)
- liaison covalente formée par le chevauchement côte à côte des orbitales atomiques ; la densité électronique se trouve de part et d'autre de l'axe internucléaire
- liaison sigma (liaison σ)
- liaison covalente formée par le chevauchement des orbitales atomiques le long de l'axe internucléaire
- théorie des liaisons de valence
- description d'une liaison qui implique que des orbitales atomiques se chevauchent pour former des liaisons σ ou π, au sein desquelles des paires d'électrons sont partagées


