3.4 : Autres unités pour les concentrations de solution
- Page ID
- 193882
- Définissez les unités de concentration du pourcentage massique, du pourcentage volumique, du pourcentage masse-volume, des parties par million (ppm) et des parties par milliard (ppb)
- Effectuer des calculs reliant la concentration d'une solution et les volumes et/ou les masses de ses composants à l'aide de ces unités
Dans la section précédente, nous avons présenté la molarité, une unité de mesure très utile pour évaluer la concentration des solutions. Cependant, la molarité n'est qu'une des mesures de concentration. Dans cette section, nous allons présenter d'autres unités de concentration couramment utilisées dans diverses applications, soit pour des raisons de commodité, soit par convention.
Pourcentage de masse
Plus tôt dans ce chapitre, nous avons introduit la composition en pourcentage comme mesure de la quantité relative d'un élément donné dans un composé. Les pourcentages sont également couramment utilisés pour exprimer la composition de mélanges, y compris de solutions. Le pourcentage en masse d'un composant de solution est défini comme le rapport entre la masse du composant et la masse de la solution, exprimé en pourcentage :
\[ \text{mass percentage} = \dfrac{\text{mass of component}}{\text{mass of solution}} \times100\% \label{3.5.1} \]
Nous sommes généralement plus intéressés par les pourcentages massiques de solutés, mais il est également possible de calculer le pourcentage massique de solvant.
Le pourcentage de masse est également désigné par des noms similaires tels que pourcentage de masse, pourcentage de poids, pourcentage poids/poids pourcentage et autres variantes de ce thème. Le symbole le plus courant pour le pourcentage de masse est simplement le signe du pourcentage, %, bien que des symboles plus détaillés soient souvent utilisés, notamment %mass, %weight et (w/w) %. L'utilisation de ces symboles plus détaillés permet d'éviter toute confusion entre les pourcentages massiques et d'autres types de pourcentages, tels que les pourcentages en volume (dont il sera question plus loin dans cette section).
Les pourcentages massiques sont des unités de concentration populaires pour les produits de consommation. L'étiquette d'un flacon d'agent de blanchiment liquide typique (Figure\(\PageIndex{1}\)) indique que la concentration de son ingrédient actif, l'hypochlorite de sodium (\(\ce{NaOCl}\)), est de 7,4 %. Un échantillon de 100 g d'eau de Javel contiendrait donc 7,4 g de\(\ce{NaOCl}\).

Un échantillon de 5,0 g de liquide céphalo-rachidien contient 3,75 mg (0,00375 g) de glucose. Quel est le pourcentage en masse de glucose dans le liquide céphalo-rachidien ?
Solution
L'échantillon de liquide céphalo-rachidien contient environ 4 mg de glucose dans 5 000 mg de liquide, de sorte que la fraction massique de glucose doit être légèrement inférieure à une partie sur 1 000, soit environ 0,1 %. En substituant les masses données dans l'équation définissant le pourcentage massique, on obtient :
\[\mathrm{\%\,glucose=\dfrac{3.75\;mg \;glucose \times \frac{1\;g}{1000\; mg}}{5.0\;g \;spinal\; fluid}=0.075\%} \nonumber \]
Le pourcentage de masse calculé correspond à notre estimation approximative (il est légèrement inférieur à 0,1 %).
Notez que si n'importe quelle unité de masse peut être utilisée pour calculer un pourcentage de masse (mg, g, kg, oz, etc.), la même unité doit être utilisée à la fois pour le soluté et la solution afin que les unités de masse s'annulent, ce qui donne un rapport sans dimension. Dans ce cas, nous avons converti les unités de soluté du numérateur de mg en g pour les faire correspondre aux unités du dénominateur. Nous aurions tout aussi bien pu convertir le dénominateur de g en mg à la place. Tant que des unités de masse identiques sont utilisées pour le soluté et la solution, le pourcentage de masse calculé sera correct.
Une bouteille de nettoyant pour carreaux contient 135 g\(\ce{HCl}\) et 775 g d'eau. Quel est le pourcentage\(\ce{HCl}\) en masse de ce nettoyant ?
- Réponse
-
14,8 %
L'acide chlorhydrique « concentré » est une solution aqueuse à 37,2 %\(\ce{HCl}\) couramment utilisée comme réactif de laboratoire. La densité de cette solution est de 1,19 g/mL. Quelle\(\ce{HCl}\) est la masse de contenue dans 0,500 L de cette solution ?
Solution
La concentration de HCl étant proche de 40 %, une portion de 100 g de cette solution contiendrait environ 40 g de HCl. Comme la densité de la solution n'est pas très différente de celle de l'eau (1 g/mL), une estimation raisonnable de la masse de HCl dans 500 g (0,5 L) de la solution est environ cinq fois supérieure à celle d'une portion de 100 g, ou\(\mathrm{5 \times 40 = 200\: g}\). Pour déduire la masse de soluté dans une solution à partir de son pourcentage massique, nous devons connaître la masse correspondante de la solution. En utilisant la densité de solution donnée, nous pouvons convertir le volume de la solution en masse, puis utiliser le pourcentage de masse donné pour calculer la masse du soluté. Cette approche mathématique est décrite dans cet organigramme :
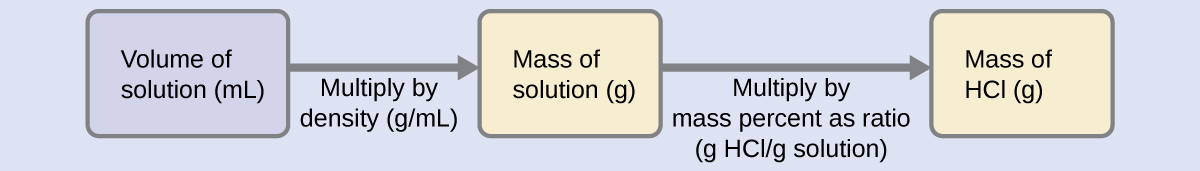
Pour une annulation appropriée de l'unité, le volume de 0,500 L est converti en 500 ml et le pourcentage massique est exprimé sous la forme d'un ratio, 37,2 g de HCl/g de solution :
\[ \mathrm{500\; mL\; solution \left(\dfrac{1.19\;g \;solution}{mL \;solution}\right) \left(\dfrac{37.2\;g\; HCl}{100\;g \;solution}\right)=221\;g\; HCl} \nonumber \]
Cette masse de HCl est conforme à notre estimation approximative d'environ 200 g.
Quel volume de solution concentrée de HCl contient 125 g de HCl ?
- Réponse
-
282 ml
Pourcentage de volume
Les volumes de liquide sur une large gamme de grandeurs sont facilement mesurés à l'aide d'équipements de laboratoire courants et relativement peu coûteux. La concentration d'une solution formée par dissolution d'un soluté liquide dans un solvant liquide est donc souvent exprimée en pourcentage volumique, en % vol ou (v/v) % :
\[ \text{volume percentage} = \dfrac{\text{volume solute}}{\text{volume solution}} \times100\% \label{3.5.2} \]
L'alcool à friction (isopropanol) est habituellement vendu sous forme de solution aqueuse à 70 % vol. Si la densité de l'alcool isopropylique est de 0,785 g/mL, combien de grammes d'alcool isopropylique sont présents dans une bouteille d'alcool à friction de 355 ml ?
Solution
Selon la définition du pourcentage volumique, le volume d'isopropanol représente 70 % du volume total de la solution. En multipliant le volume d'isopropanol par sa densité, on obtient la masse requise :
\[ \text {355 mL solution}(\frac{\text{70 mL isopropyl alcohol}}{\text{100 mL solution}})(\frac{\text{0.785 g isopropyl alcohol}}{\text{1 mL isopropyl alcohol}})=\text{195 g isopropyl alcohol} \nonumber \]
Le vin contient environ 12 % d'éthanol (\(\ce{CH_3CH_2OH}\)) en volume. L'éthanol a une masse molaire de 46,06 g/mol et une densité de 0,789 g/mL. Combien de moles d'éthanol sont présentes dans une bouteille de vin de 750 ml ?
- Réponse
-
1,5 mol d'éthanol
Pourcentage masse-volume
Les unités de pourcentage « mixtes », dérivées de la masse du soluté et du volume de solution, sont populaires pour certaines applications biochimiques et médicales. Un pourcentage masse-volume est un rapport entre la masse d'un soluté et le volume de la solution exprimé en pourcentage. Les unités spécifiques utilisées pour la masse du soluté et le volume de solution peuvent varier en fonction de la solution. Par exemple, une solution saline physiologique, utilisée pour préparer des liquides intraveineux, a une concentration de 0,9 % masse/volume (m/v), ce qui indique que la composition est de 0,9 g de soluté pour 100 ml de solution. La concentration de glucose dans le sang (communément appelée « sucre dans le sang ») est également généralement exprimée en termes de rapport masse-volume. Bien qu'elle ne soit pas exprimée explicitement en pourcentage, sa concentration est généralement donnée en milligrammes de glucose par décilitre (100 ml) de sang (Figure\(\PageIndex{2}\)).

Parties par million et parties par milliard
Les très faibles concentrations de soluté sont souvent exprimées à l'aide d'unités suffisamment petites, telles que des parties par million (ppm) ou des parties par milliard (ppb). Tout comme les unités de pourcentage (« partie par cent »), les ppm et les ppb peuvent être définis en termes de masses, de volumes ou d'unités masse-volume mixtes. Il existe également des unités ppm et ppb définies par rapport au nombre d'atomes et de molécules.
Les définitions en fonction de la masse des ppm et des ppb sont données ici :
\[\text{ppm}=\dfrac{\text{mass solute}}{\text{mass solution}} \times 10^6\; \text{ppm} \label{3.5.3A} \]
\[\text{ppb}=\dfrac{\text{mass solute}}{\text{mass solution}} \times 10^9\; \text{ppb} \label{3.5.3B} \]
Le ppm et le ppb sont des unités pratiques pour signaler les concentrations de polluants et d'autres contaminants à l'état de traces dans l'eau. Les concentrations de ces contaminants sont généralement très faibles dans les eaux traitées et naturelles, et leurs niveaux ne peuvent pas dépasser des seuils de concentration relativement bas sans avoir d'effets nocifs sur la santé et la faune. Par exemple, l'EPA a déterminé que la concentration maximale sûre d'ions fluorure dans l'eau du robinet était de 4 ppm. Les filtres à eau intégrés sont conçus pour réduire la concentration de fluorure et de plusieurs autres contaminants à l'état de traces dans l'eau du robinet (Figure\(\PageIndex{3}\)).

Selon l'EPA, lorsque la concentration de plomb dans l'eau du robinet atteint 15 ppb, certaines mesures correctives doivent être prises. Quelle est cette concentration en ppm ? À cette concentration, quelle masse de plomb (μg) serait contenue dans un verre d'eau typique (300 ml) ?
Solution
Les définitions des unités ppm et ppb peuvent être utilisées pour convertir la concentration donnée de ppb en ppm. La comparaison de ces deux définitions d'unités montre que le ppm est 1 000 fois supérieur au ppb (1 ppm = 10 3 ppb). Ainsi :
\[ \mathrm{15\; \cancel{ppb} \times \dfrac{1\; ppm}{10^3\;\cancel{ppb}} =0.015\; ppm} \nonumber \]
La définition de l'unité ppb peut être utilisée pour calculer la masse demandée si la masse de la solution est fournie. Cependant, seul le volume de solution (300 ml) est donné, nous devons donc utiliser la densité pour obtenir la masse correspondante. Nous pouvons supposer que la densité de l'eau du robinet est à peu près la même que celle de l'eau pure (~1,00 g/mL), car les concentrations de substances dissoutes ne doivent pas être très importantes. En réorganisant l'équation définissant l'unité ppb et en substituant les quantités données, on obtient :
\[\text{ppb}=\dfrac{\text{mass solute}}{\text{mass solution}} ×10^9\; \text{ppb} \nonumber \]
\[\text{mass solute} = \dfrac{\text{ppb} \times \text{mass solution}}{10^9\;\text{ppb}} \nonumber \]
\[\text{mass solute}=\mathrm{\dfrac{15\:ppb×300\:mL×\dfrac{1.00\:g}{mL}}{10^9\:ppb}=4.5 \times 10^{-6}\;g} \nonumber \]
Enfin, convertissez cette masse en l'unité de microgrammes demandée :
\[\mathrm{4.5 \times 10^{−6}\;g \times \dfrac{1\; \mu g}{10^{−6}\;g} =4.5\; \mu g} \nonumber \]
Un échantillon de 50,0 g d'eaux usées industrielles a été déterminé comme contenant 0,48 mg de mercure. Exprimer la concentration de mercure des eaux usées en ppm et ppb.
- Réponse
-
9,6 ppm, 9 600 ppb
Résumé
Outre la molarité, un certain nombre d'autres unités de concentration de solution sont utilisées dans diverses applications. Les concentrations en pourcentage basées sur les masses, les volumes ou les deux des composants de la solution sont utiles pour exprimer des concentrations relativement élevées, tandis que les concentrations plus faibles sont exprimées de manière pratique en unités de ppm ou de ppb. Ces unités sont populaires dans les domaines environnemental, médical et autres où les unités basées sur les taupes, telles que la molarité, ne sont pas aussi couramment utilisées.
Lexique
- pourcentage de masse
- rapport entre la masse du soluté et de la solution exprimé en pourcentage
- pourcentage masse-volume
- rapport entre la masse du soluté et le volume de la solution, exprimé en pourcentage
- parties par milliard (ppb)
- rapport entre la masse du soluté et de la solution multiplié par 10 9
- parties par million (ppm)
- rapport entre la masse du soluté et de la solution multiplié par 10 6
- pourcentage de volume
- rapport entre le volume du soluté et de la solution exprimé en pourcentage


